52 واکسن
در تعداد کمی از افراد سالم و جوان برای ارزیابی میزان ایمنی و دوز صحیح آزمایش می شوند37 واکسن
به یک گروه بزرگتر از افراد ، از جمله افرادی که در معرض خطر بیشتری از بیماری هستند، گسترش می یابد13 واکسن
چین و روسیه واکسن ها را بدون انتظار برای نتایج آزمایشات فاز 3 تصویب کرده اند. کارشناسان می گویند این روند عجولانه خطرات جدی دارد.محققان در حال حاضر بر روی 116 واکسن در آزمایشگاه تحقیق و بررسی میکنند که از این تعداد 49 واکسن به مراحل نهایی آزمایش رسیده و واکسن های کرونا تایید شده هستند اما بیش از 75 واکسن پیش بالینی در حیوانات تحت بررسی فعال هستند. لازم بذکر است که مراحل تحقیق و توسعه یک واکسن سالها بطول می انجامد ولی در مورد ویرس کرونا شرکت های داروسازی سراسر دنیا در حال رقابت گسترده ای هستند که یک واکسن موثر با امنیت بالا را در اختیار مردم قرار بدهند در واقع انواع واکسن کرونا با کشور سازنده متفاوت در سراسر جهان وجود دارد که حتی به مرحله نهایی هم رسیدهاند.
مجله پزشکی سلامت سیب همواره قصد داشته که اطلاعات دقیق پزشکی و سلامتی معتبر را در اختیار هموطنان عزیزمان قرار بدهد تا عزیزانمان بدور از شایعات و غرایز شخصی دانش خود را در مورد مسائل روز پزشکی و سلامتی افزایش بدهند.
در اینجا رسالت خود دیدیم که در این شرایط سخت در کنار شما دوستان عزیز باشیم و با استفاده از منابع علمی وخبری معتبر موجود در دنیا مراحل پیشرفت واکسن کوید ۱۹ توسط شرکت های مختلف و انواع واکسن کرونا با کشور سازنده را بصورت زنده دنبال کنیم واطلاعات بروز و معتبری را در اختیار شما قرار دهیم. لازم بذکر است که این اطلاعات بر اساس گزارش شرکت های داروسازی و انواع واکسن کرونا تایید بهداشت جهانی در دنیا می باشد و مطالب و ویدیو های تکمیلی را در وبسایت مجله سیب و شبکههای اجتماعی مجله سیب به اشتراک خواهیم گذاشت.
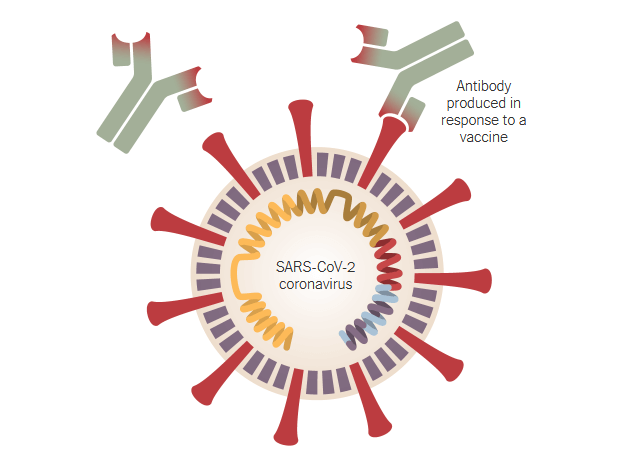
کار تولید واکسن در ژانویه با رمزگشایی ژن SARS-CoV-2 آغاز شد. اولین آزمایشات ایمنی واکسن از ماه مارس بر روی انسان آغاز شد و اکنون 10 واکسن به مراحل نهایی آزمایش رسیده اند. برخی از این آزمایشات با شکست روبرو می شوند و برخی دیگر ممکن است بدون نتیجه مشخص به پایان برسند. چند واکسن ممکن است در تحریک سیستم ایمنی بدن برای تولید آنتی بادی موثر علیه ویروس موفق شوند جز واکسن های کرونا تایید شده دستهبندی شوند.
در ادامه وضعیت انواع واکسن کرونا تایید بهداشت جهانی شده را بررسی کرده و از آخرین تغییرات و بروزرسانی آنها خواهیم گفت.
آپدیت شده در 26 بهمن
منابع :
Sources: World Health Organization, National Institute of Allergy and Infectious Diseases, National Center for Biotechnology Information, New England Journal of Medicine.
فاز 1
داروهای زیستی Gennova در هند و HDT Bio مستقر در سیاتل برای تولید واکسنی مبتنی بر RNA خود تقویت کننده همکاری کردند. این واکسن که به HGC019 معروف است ، توانست حیوانات را با ایجاد تحریک برای ایجاد آنتی بادی علیه ویروس کرونا تحریک کند و این باعث شد هند در دسامبر سال 2020 برای شروع آزمایشات مرحله 1/2 به این شرکتها مجوز بدهد. در 4 مه 2021 HDT اعلام کرد دادگاه در هند در حال انجام است.
Updated May 18GeneOne Life Science ، یک شرکت بیوتکنولوژی کره جنوبی ، یک واکسن مبتنی بر DNA ایجاد کرد که دو پروتئین ویروس کرونا را کد می کند. در دسامبر 2020 ، آنها آزمایش فاز 1/2 را با 345 شرکت کننده آغاز کردند. پس از دریافت نتایج موقت مثبت از آزمایش ، GeneOne در 8 ژوئیه 2021 اعلام کرد که مرحله 2 را آغاز می کند.
GeneOne همچنین در حال آزمایش تکنیکهای مختلف تحویل واکسن است. در 20 اکتبر، این شرکت یک آزمایش فاز 1 را ثبت کرد تا ارزیابی کند که کاندیدای آنها وقتی به بازوی بیمار تزریق می شود و به عنوان اسپری بینی تحویل داده می شود، چقدر خوب کار می کند. در این مطالعه، محققان همچنین خواهند دید که آیا یک دستگاه مکش پوست نتایج را بهبود می بخشد یا خیر. در ژانویه 2022، GeneOne آزمایش جدیدی را برای آزمایش واکسن خود به عنوان یک تقویت کننده ثبت کرد.
شرکت کره جنوبی ژنکسین آزمایش ایمنی واکسن مبتنی بر DNA را در ژوئن 2020 آغاز کرد. در ماه دسامبر ، کره بیومدیکال ریویو گزارش داد که ژنکسین از فرمول اولیه آنها نتایج ناامیدکننده ای به دست آورد و تصمیم گرفت آزمایشات خود را با واکسن اصلاح شده دوباره آغاز کند. در 20 ژانویه 2021 ، شرکت آزمایشی مرحله 1/2 را ثبت کرد و در ماه ژوئن آزمایش فاز 1 را برای داوطلبان مسن ثبت کردند.
شرکت دارویی اندونزیایی Kalbe Farma در ماه آوریل متعهد شد که در صورت ایمن و م safeثر بودن 10 میلیون دوز واکسن ژنکسین را خریداری کند. در ماه جولای ، تنظیم کننده های اندونزی برای آزمایش بالینی مرحله 2/3 چراغ سبز نشان دادند.
Updated Aug. 4محققان دانشگاه Chulalongkorn تایلند چندین واکسن احتمالی را برای ویروس کرونا تولید کرده اند. دورترین مرحله یک واکسن مبتنی بر mRNA است که به ChulaCov19 معروف است. در سپتامبر 2020 ، مرکز تحقیقات واکسن چولا آزمایش فاز 1 را برای آزمایش آن بر روی انسان ثبت کرد. تأخیر در تأمین منابع مالی و تولید ، روند مطالعه را تا ژوئن 2021 کاهش داد. در مصاحبه ای با بانکوک پست ، رهبر پروژه گفت که اگر ایمن بودن واکسن ممکن است تا 30 میلیون دوز برای تایلند و شش کشور دیگر آسیایی تولید شود.
Updated June 16شرکت کانادایی Entos Pharmaceuticals یک واکسن DNA برای ویروس کرونا ایجاد کرده است. بیشتر واکسن های ژنتیکی دیگر ژن پروتئین سنبله را در سطح ویروس حمل می کنند. در عوض Entos ژن را برای نوکلئو کپسید ، پروتئینی که درون غشا ویروس قرار دارد ، انتخاب کرد. آنها شرط می بندند که این می تواند مصونیت طولانی مدت داشته باشد. در اکتبر سال 2020 ، انتوس یک آزمایش فاز 1 را برای واکسن خود در کانادا آغاز کرد ، به نام Covigenix VAX-001. آنها دوز مصرف کنندگان را از 15 آوریل آغاز کردند.
Entos C.E.O. جان لوئیس در 4 آگوست به رسانه های کانادایی گفت که واکسن پاسخ ایمنی کافی و بدون واکنش های جانبی ایجاد کرد. لوئیس بعداً در دسامبر 2021 به Owen Sound Sun Times گفت که آزمایش فاز 2 در آفریقای جنوبی در اوایل سال 2022 آغاز خواهد شد. Entos همچنین یکی از چهار سازنده واکسن است که بخشی از تعهد 81.2 میلیون دلاری از دولت آلبرتا برای توسعه نامزدهای خود دریافت کرده است. .
در تاریخ 2 نوامبر ، شرکت کانادایی Symvivo اعلام کرد که آنها یک واکسن DNA را برای اولین داوطلب خود در یک آزمایش فاز 1 تزریق کرده اند. DNA درون باکتریهای بی ضرری قرار می گیرد که داوطلبان آن را در مایع منجمد می بلعند (شرکت در حال کار بر روی قرار دادن باکتری ها در یک قرص است). هنگامی که باکتری ها به روده می رسند ، DNA به درون سلول های روده لغزیده و سپس پروتئین های ویروسی را ایجاد می کند.
Symvivo در 19 ژوئیه اعلام کرد که نزدیک به 5 میلیون دلار از برنامه کمک تحقیقات صنعتی شورای ملی تحقیقات کانادا برای ادامه توسعه واکسن خود کمک مالی دریافت کرده است. بر اساس ثبت کارآزمایی، نتایج کارآزمایی در اواخر فوریه 2022 انتظار میرود.
ایمنی درمانی OncoSec مستقر در نیوجرسی ، درمان های آزمایشی سرطانی را تولید کرده است که ژن ها را به تومورها منتقل می کند. در آنجا ، ژن های تزریق شده یک مولکول سیگنالینگ طبیعی به نام IL-12 تولید می کنند که توجه سلول های ایمنی را که به سرطان حمله می کنند ، جلب می کند. در بهار ، OncoSec شروع به تطبیق فناوری خود برای ساخت واکسن برای ویروس کرونا کرد. این واکسن که CORVax12 نام دارد از یک حلقه DNA تشکیل شده است که هم پروتئین سنبله و هم IL-12 را کد می کند. ایجاد بدن برای تولید IL-12 اضافی می تواند به طور بالقوه توانایی سیستم ایمنی بدن را در ایجاد آنتی بادی های پروتئین سنبله افزایش دهد. در 27 ژانویه ، این شرکت برای آزمایش ایمنی CORVax12 ، دوزهای شرکت کنندگان در آزمایش فاز 1 خود را آغاز کرد.
در ماه نوامبر، سخنگویی گفت که OncoSec دیگر در حال بررسی واکسن نیست.
در حالی که بسیاری از واکسن ها به صورت تزریق تزریق می شوند ، برخی از واکسن ها را می توان به صورت قرص مصرف کرد. واکسن های خوراکی برای بیماری هایی از جمله فلج اطفال ، وبا و تب حصبه تأیید شده اند. شرکت کوچک سانفرانسیسکو Vaxart در زمینه تولید واکسن های خوراکی تخصص دارد. آنها قرص هایی را برای آنفلوانزا و سایر بیماری ها ایجاد و آزمایش کرده اند. بهار گذشته وکسارت کار بر روی واکسن خوراکی Covid-19 را آغاز کرد. این شامل یک آدنو ویروس به نام Ad5 (همان ناقل ویروسی در واکسن CanSinoBio و Sputnik V روسیه) است.
هنگامی که وکسارت این قرص را به موش ها داد ، آنها آنتی بادی علیه ویروس کرونا تولید کردند. با این حال موش ها از علائم Covid-19 رنج نمی برند ، بنابراین محققان به سمت همسترها روی می آورند که باعث می شود. در یک مطالعه منتشر نشده ، آنها دریافتند که قرص واکسن نه تنها میزان ویروس کرونا را در همسترهای بیمار به طرز چشمگیری کاهش می دهد ، بلکه آنها را از دو علامت مهم بیماری محافظت می کند: کاهش وزن و تورم ریه ها.
قیمت سهام این شرکت در نیمه اول سال 2020 3600 درصد افزایش یافت. در ماه ژوئن ، نیویورک تایمز گزارش داد ، صندوق تامینی که بخشی از آن را کنترل می کرد ، بیشتر سهام خود را فروخت و بیش از 200 میلیون دلار سود کسب کرد. در پی آن گزارش ، وزارت دادگستری تحقیق در مورد این شرکت را آغاز کرد ، در حالی که تعدادی از پرونده های حقوقی سهامداران علیه وکسارت ، مدیران و هیئت مدیره آن تشکیل شد.
در ماه اکتبر ، این شرکت دادن یک قرص به داوطلبان در یک آزمایش بالینی فاز 1 آغاز کرد. در 3 فوریه ، واکسارت اعلام کرد که دادگاه هیچ نگرانی جدی در زمینه ایمنی نشان نمی دهد. در حالی که این قرص پاسخی از سلولهای T ایجاد می کند ، اما آنتی بادی های خنثی کننده دلگرم کننده تولید نمی کند. اخبار قیمت سهام آن 60 درصد افت کرد. در 25 فوریه ، این شرکت اعلام کرد که به محاکمه فاز 2 در سه ماهه دوم سال 2021 صعود می کند.
در 25 فوریه، این شرکت اعلام کرد که به مرحله آزمایشی فاز 2 در سه ماهه دوم سال 2021 می رود، اما مشکلات تولید آنها را مجبور به تاخیر در راه اندازی کرد. در 5 اکتبر، Vaxart یک آزمایش فاز 2 را ثبت کرد. در مطالعه جدید، این شرکت قرص خود را به عنوان واکسن اولیه بر روی داوطلبان واکسینه نشده و به عنوان یک تقویت کننده برای افرادی که قبلا واکسن مجاز دریافت کرده اند، آزمایش خواهد کرد. محققان اولین شرکت کننده خود را در 26 اکتبر دوز مصرف کردند.
سه دهه پیش ، مرکز تحقیقات عفونی آلمان یک واکسن آبله را از ویروس بی ضرری به نام Modified Vaccinia Ankara یا به اختصار MVA تولید کرد. در سالهای اخیر ، آنها آن را برای ایجاد واکسن برای MERS ، بیماری ناشی از ویروس کرونا دیگر ، سازگار کردند. این بهار ، آنها یک واکسن مبتنی بر MVA برای SARS-CoV-2 ، ویروس کرونا که عامل همه گیری Covid-19 است ، ساختند. ژن پروتئین سنبله را که درون سلولهایی که به آنها حمله می کند ، تولید می کند. در تاریخ 29 سپتامبر ، مرکز و کنسرسیومی از دانشگاههای آلمان یک آزمایش فاز 1 را ثبت کردند. در ماه ژانویه ، این مرکز اعلام کرد که فرمول بندی اولیه آنها نتایج ناامیدکننده ای را ارائه می دهد و دادگاه را به روز می کنند تا آن را به روز کنند.
محققان در ماه نوامبر اعلام کردند که در حال ارزیابی واکسن مبتنی بر MVA در آزمایشات فاز 1 به عنوان یک تقویت کننده و در افراد واکسینه نشده هستند. آنها دادگاه را در 7 فوریه 2022 ثبت کردند.
شرکت ImmunityBio مستقر در کالیفرنیا واکسنی را با استفاده از آدنوویروس Ad5 ایجاد کرد ، همان واکسنی که توسط CanSinoBio و موسسه گامالیا در روسیه مورد استفاده قرار گرفت. ImmunityBio مهندسی ویروس Ad5 را انجام داد تا ژن دو ژن ویروس کرونا را حمل کند. علاوه بر پروتئین سنبله ، ژن پروتئینی به نام نوکلئوکپسید را نیز حمل می کند. این شرکت امیدوار است که این ترکیب واکنش ایمنی قوی را برانگیزد.
این شرکت دریافت که این واکسن میمون ها را در برابر ویروس کرونا محافظت می کند. ImmunityBio آزمایش فاز 1 واکسن Covid-19 را در اکتبر 2020 در ایالات متحده و دیگری در آفریقای جنوبی در ژانویه آغاز کرد. در فوریه 2021 ، این شرکت آزمایش فاز 1 نسخه شفاهی واکسن را ثبت کرد.
در 25 مه ، این شرکت اعلام کرد که مطالعه می کند که نامزد آنها چگونه برای افرادی که قبلاً واکسن های دیگر دریافت کرده اند به عنوان یک تقویت کننده عمل می کند. آنها همچنین در حال آزمایش نسخه اسپری بینی هستند. آنها در 14 ژوئیه گفتند که آزمایشات تقویت کننده شات در اواخر امسال در آفریقای جنوبی آغاز می شود.
رئیس و C.E.O. از ImmunityBio میلیاردر پاتریک سون شیونگ ، صاحب روزنامه لس آنجلس تایمز است.
Updated Dec. 22محققان City of Hope ، م institسسه تحقیقات زیست پزشکی کالیفرنیا ، واکسنی را بر اساس شکل تضعیف شده ویروس به نام Modified Vaccinia Ankara یا به اختصار MVA ایجاد کردند. آنها دو ژن کروناویروس را به ویروس اضافه کردند - یکی برای پروتئین سنبله و دیگری برای پروتئینی دیگر به نام نوکلئوکپسید. آنها امیدوارند این ترکیب واکسن را قادر به ایجاد ایمنی سریع و طولانی مدت کند.
در 24 نوامبر 2020، شهر امید شروع فاز 1 آزمایشی را اعلام کرد. در سپتامبر 2021، محققان فاز 2 آزمایشی را راه اندازی کردند و واکسن را به داوطلبان مبتلا به سرطان خون که پیوند مغز استخوان یا نوعی ایمونوتراپی به نام CAR-T دریافت کرده بودند، ارائه کردند. در 9 نوامبر، GeoVax اعلام کرد که حقوق انحصاری برای توسعه واکسن به نام COH04S1 و عرضه آن در سراسر جهان به آن اعطا شده است. GeoVax اولین شرکت کننده را در آزمایش تقویت کننده فاز 2 در دسامبر دوز مصرف کرد.

در آوریل 2020 ، شرکت بیوتکنولوژی کره جنوبی Cellid شروع به تولید واکسنی برای کووید -19 کرد. این واکسن بر اساس ترکیبی از دو گونه آدنوویروس به نام Ad5 و Ad35 ساخته شده است. پس از آزمایش واکسن روی میمون ها ، Cellid با تولید کننده شیمیایی کره جنوبی LG Chem برای تولید واکسن همکاری کرد. در دسامبر 2020 ، آنها آزمایش فاز 1 را ثبت کردند. رسانه های کره ای گزارش دادند که Celid از دولت برای شروع آزمایش مرحله اول فرمول جدید واکسن در 23 ژوئیه 2021 تأیید کرد.
Celid انتظار دارد آزمایش فاز 1 واکسن به روز شده را در اکتبر 2021 به پایان برساند و در نظر دارد نتایج ایمنی و اثربخشی نهایی را در سه ماهه دوم سال 2022 به دست آورد. این شرکت قصد دارد فاز 3 آزمایشی را به عنوان مقایسه ای بین واکسن سلید و جانسون اجرا کند. ، اما در تامین دوزهای کافی J&J برای اجرای مطالعه با مشکل مواجه است.
نام واکسن: AdCOVID
کارایی: ناشناخته
دوز: 1 دوز
نوع: اسپری بینی
ذخیره سازی: در یخچال
Altimmune مستقر در مریلند یک شرکت زیست دارویی است که تمرکز خود را بر روی تولید واکسن هایی که توسط اسپری بینی انجام می شوند ، دارد. اخیراً ، آنها با استفاده از این فناوری با آنفلوانزا و سیاه زخم مقابله کرده اند. آنها اکنون از آن برای ساخت واکسن اسپری بینی برای Covid-19 استفاده کرده و آدنو ویروس Ad5 را به مجاری تنفسی می رسانند. این شرکت می گوید اسپری بینی آن ممکن است برای جلوگیری از انتقال ویروس موثرتر از واکسن های تزریقی باشد. در مطالعه ای روی موش ها ، محققان AltImmune دریافتند که تنها یک دوز واکسن از عفونت کشنده ویروس های کرونا محافظت کامل می کند. در 22 دسامبر ، این شرکت یک آزمایش بالینی فاز 1 از یک دوز واکسن را ثبت کرد ، که انتظار می رود نتایج آن در ژوئن 2021 ارائه شود.
اما در 29 ژوئن 2021، Altimune اعلام کرد که واکسن کووید-19 خود را کنار میگذارند. در آزمایش فاز 1 خود، آنها اسپری را به 80 داوطلب دادند و دریافتند که آنها سطوح پادتن بسیار کمتری نسبت به تولید واکسنهای کووید-19 تولید میکنند که قبلاً مجاز بودهاند.
دانشمندان قزاقستانی در انستیتوی تحقیقات مشکلات ایمنی بیولوژیکی ، واکسن دوم علیه Covid-19 تولید کرده اند. برخلاف مورد اول که از ویروس های کرونا ویروس غیرفعال ساخته می شود ، این پروتئین از ویروس برای تقویت ایمنی استفاده می کند. آنها آزمایش فاز 1/2 واکسن را با نام QazCoVac-P در 15 ژوئن آغاز کردند.
سوابق کارآزمایی که نشان میداد این مطالعه در دسامبر 2021 به پایان میرسد، از ژوئیه 2021 بهروزرسانی نشده است.
محققان این موسسه گزارشی از آزمایش فاز 3 خود را در ژانویه 2022 منتشر کردند. آنها دریافتند که این واکسن اثربخشی 82 درصدی در برابر عفونت دارد. کارآزمایی برای تعیین اثربخشی در برابر بیماری شدید بسیار کوچک بود. این مطالعه هنوز در یک مجله علمی منتشر نشده است.


در اوایل سال 2020، سانوفی واکسن کووید-19 را بر اساس پروتئینهای ویروسی که با ویروسهای مهندسی شده تولید میکردند تولید کرد که در داخل سلولهای حشرات رشد میکنند. GSK این پروتئین ها را با ادجوانت هایی که سیستم ایمنی را تحریک می کنند تکمیل کرد. این واکسن که Vidprevtyn نام دارد بر اساس همان طرحی است که Sanofi برای ساخت Flublok، واکسن تایید شده برای آنفولانزا، استفاده کرد. این شرکتها آزمایش بالینی فاز 1/2 را در سپتامبر 2020 راهاندازی کردند.
انتظار می رفت که Vidprevtyn نقش مهمی در مقابله با همه گیری ایفا کند. در ایالات متحده، عملیات Warp Speed آن را به عنوان یکی از شش واکسن برای ایمن سازی در مقادیر زیاد انتخاب کرد و به توافقی 2.1 میلیارد دلاری برای 100 میلیون دوز دست یافت. در 18 سپتامبر سانوفی قرارداد دیگری با اتحادیه اروپا برای 300 میلیون دوز برای مقدار نامشخصی منعقد کرد و بعداً با کانادا برای 72 میلیون دوز به توافق رسید. علاوه بر این، سانوفی موافقت کرد که 200 میلیون دوز برای COVAX، یک همکاری بینالمللی برای تحویل عادلانه واکسن در سراسر جهان، ارائه کند. این شرکت انتظار داشت در ماه دسامبر به فاز 3 آزمایشی منتقل شود و احتمالاً تا بهار 2021 به دنبال مجوز استفاده اضطراری برای Vidprevtyn در ایالات متحده باشد. سانوفی اعلام کرد که قصد دارد تا یک میلیارد دوز در سال 2021 ایجاد کند.
اما در 11 دسامبر 2020، Sanofi و GSK اعلام کردند که Vidprevtyn ناامیدکننده است. در حالی که سطوح امیدوارکننده ای از آنتی بادی ها را در افراد زیر 50 سال ارائه می کرد، افراد مسن تر به آن شدتی که انتظار داشتند پاسخ ندادند. شرکت آزمایشی را متوقف کرد. در ژانویه سانوفی تصمیم گرفت به فایزر و BioNTech کمک کند تا 100 میلیون دوز از واکسن خود را تولید کنند و آنها به توافقی مشابه با جانسون و جانسون در ماه فوریه دست یافتند.
در همین حال، سانوفی فرمول قوی تری از Vidprevtyn را توسعه داد. در 22 فوریه، شرکت فاز 2 آزمایشی جدیدی را راه اندازی کرد که نشان داد نسخه جدید پاسخ های ایمنی قوی ایجاد می کند. آنها شروع به ثبت نام شرکت کنندگان برای فاز 3 آزمایشی خود در 27 مه کردند. در 20 ژوئیه 2021، آژانس دارویی اروپا یک بررسی چرخشی از Vidprevtyn را قبل از درخواست آنها برای مجوز آغاز کرد. سانوفی در گزارشی از درآمد در 28 اکتبر گفت که انتظار داشت نتایج آزمایشی فاز 3 جدید خود را تا پایان سال 2021 نشان دهد، اما در 15 دسامبر، این شرکت اعلام کرد که این آزمایش تا اوایل سال 2022 ادامه خواهد داشت زیرا تعداد بسیار کمی از شرکت کنندگان به بیماری مبتلا شده اند. کووید 19. با این حال، نتایج یک آزمایش تقویت کننده امیدوارکننده بود. داوطلبان واکسینه شده که واکسن شرکت را به عنوان یک تقویت کننده دریافت کردند، شاهد افزایش زیادی در آنتی بادی های ضد ویروس کرونا بودند.
Updated Dec. 16SpyBiotech ، شرکتی که از دانشگاه آکسفورد جدا شد ، واکسنی را از مخلوط پروتئین ها تولید کرد. برخی از پروتئین ها ، از ویروس های هپاتیت B ، پوسته های توخالی را تشکیل می دهند. محققان این پوسته ها را با بخشی از پروتئین سنبله کروناویروس تزئین کردند. ساخت واکسن نسبتاً آسان است زیرا پروتئین ها را می توان با تخمیر مخمر تولید کرد. پس از خالص شدن ، پروتئین ها خود را به صورت پوسته جمع می کنند.
واکسن تزریق شده به میمون ها سطح امیدوار کننده ای از پاسخ های ایمنی را ایجاد کرد. در سپتامبر 2020 ، SpyBiotech اعلام کرد که اولین داوطلبان در آزمایش مرحله 1/2 استرالیا واکسن Covid-19 خود را دریافت می کنند. موسسه سرم هند ، که مجوز این فناوری را از SpyBiotech صادر کرده است ، آزمایشات را اجرا می کند.
اما پرونده آزمایشی که از سپتامبر 2020 به روز نشده است، نشان می دهد که محققان تنها 9 داوطلب از 280 مورد انتظار را جذب کرده اند.
شیونوگی ، غول داروسازی ژاپنی ، آزمایش فاز 1/2 واکسن کرونا را در 16 دسامبر آغاز کرد. این شرکت آن را با همکاری موسسه ملی بیماریهای عفونی و دانشگاه کیوشو توسعه داد. این واکسن بر اساس پروتئین کروناویروس ساخته شده است که در سلول های حشرات توسط ویروس های تغییر یافته ژنتیکی تولید می شود. اما بر اساس گزارش ماه مارس از ژاپن تایمز ، شیونوگی برای جذب شرکت کنندگان کافی برای آزمایشات خود با مشکل روبرو شده است و بعید است که واکسن تا پایان سال 2021 آماده شود. با سرمایه گذاران ، شیونوگی گفت که پس از دریافت نتایج اولیه ناامیدکننده از آزمایش اولیه ، از یک مکمل جدید با واکسن خود استفاده می کند. آنها گفتند که آزمایش جدید مرحله 1/2 در ژوئیه 2021 آغاز شد.
Updated Aug. 4دومین واکسن گیاهی در Kentucky BioProcessing ، یکی از شرکت های تابعه British American Tobacco ، سازنده Lucky Strike و سیگارهای دیگر در دست تولید است. مانند مدیگوگو ، مهندسین كنتاكی BioProcessing یكی از اقوام وحشی توتون به نام Nicotiana benthamiana برای ساخت پروتئین های ویروسی تولید كرد. این شرکت قبلاً از این روش برای ساخت دارویی به نام Zmapp برای ابولا استفاده می کرد. دادرسی فاز 1 در دسامبر آغاز شد.
British American Tobacco در 10 ژانویه 2022 اعلام کرد که شرکت تابعه واکسن خود را که قبلا کنتاکی BioProcessing نامیده می شد، به شرکت جدیدی به نام KBio تبدیل می کند.
Adimmune سازنده واکسن مستقر در تایوان مجوز آزمایش فاز 1 را در 20 آگوست 2020 دریافت کرد. این واکسن حاوی بخش RBD پروتئین سنبله ویروس است. در ماه دسامبر ، مطبوعات تایوان گزارش دادند که Adimmune نتوانسته دوز مناسب واکسن خود را پیدا کند و نیاز به آزمایش فرمول جدید دارد. Adimmune در ماه فوریه 2021 اعلام کرد که تحقیقات واکسن را برای هدف قرار دادن انواع جدید تغییر خواهد داد. در ماه سپتامبر، این شرکت مجوز راه اندازی فاز 1/2 آزمایشی جدید را دریافت کرد.
Updated Jan. 3در بهار ، محققان دانشگاه توبینگن در آلمان واکسنی ساخته شده از هشت قسمت از دو پروتئین ویروسی ، همراه با یک کمکی تحریک کننده سیستم ایمنی ایجاد کردند. در ماه سپتامبر آنها یک آزمایش فاز 1 را آغاز کردند.
Updated June 1نام واکسن: COVAC
اثربخشی: نامشخص
دوز: 2 دوز به فاصله 4 هفته
نوع: تزریق عضلانی
سازمان واکسن و بیماریهای عفونی در دانشگاه ساسکاچوان دو واکسن کاندید تولید کرده است که از تکههایی از پروتئینهای ویروسی برای ایجاد ایمنی در برابر ویروس کرونا استفاده میکنند. VIDO مرحله 1 آزمایشی برای COVAC-2 را در 8 ژانویه 2021 ثبت کرد. اما به گزارش CTV نیوز ساسکاتون، از آنجایی که دریافت واکسن های تایید شده در کانادا آسان تر شد، برخی از داوطلبان شروع به کنار گذاشتن آزمایش کردند. با این حال، در 15 سپتامبر، مدیر VIDO، Volker Gerdts به Global News Morning گفت که پس از دریافت نتایج اولیه امیدوارکننده، در حال انتقال به مرحله آزمایشی فاز 2 است. وی همچنین گفت که VIDO با انستیتو پاستور در سنگال همکاری می کند تا واکسن را در آفریقا عرضه کند. در 4 نوامبر، CEPI اعلام کرد که 5 میلیون دلار برای حمایت از توسعه واکسن اختصاص داده است. VIDO فاز 2 آزمایشی را برای COVAC-2 در ژانویه 2022 ثبت کرد. VIDO آزمایش فاز 1 دیگری را برای دیگر نامزد واکسن خود، COVAC-1، در 14 دسامبر در کانادا و برزیل ثبت کرد.
Updated Jan. 28
در تاریخ 18 ژوئیه ، کمیسیون دولتی علوم و فناوری کره شمالی در وب سایت خود اعلام کرد که آنها آزمایشات بالینی واکسن مبتنی بر بخشی از پروتئین سنبله ویروس کرونا را آغاز کرده اند. ارزیابی مستقل ادعای دیکتاتوری منزوی دشوار است. این کمیسیون ادعا کرد که این واکسن را بر روی حیوانات آزمایش کرده است ، اما هیچ اطلاعاتی ارائه نکرد. چهار ماه پس از اعلامیه ، قانون گذاران کره جنوبی گفتند که تلاش کره شمالی برای هک شرکت های کره جنوبی که واکسن ویروس کرونا را تولید می کنند ، خنثی کرده اند. تاکنون کره شمالی هیچ اطلاعات بیشتری در مورد دادگاههایی که احتمالاً در حال اجرا هستند منتشر نکرده است.
Updated Dec. 2مرکز چوماکوف در آکادمی علوم روسیه یک واکسن ویروس کرونا ویروس غیرفعال به نام CoviVac تولید کرد. در 14 اکتبر ، تاس گزارش داد که آزمایشات بالینی واکسن از 19 مهر در Kirov و سن پترزبورگ آغاز می شود. در 20 فوریه ، روسیه این واکسن را برای مصارف خانگی تصویب کرد ، علی رغم این واقعیت که مرکز چوماکوف بعداً شروع به کار کرد آزمایش فاز 3 در تاریخ 3 ژوئن ، مدیر مرکز چوماکوف گفت که آزمایش هنوز در جریان است و هنوز نمی توان در مورد اثر واکسن صحبت کرد.
این کارگردان در 24 اوت گفت که مرکز چوماکوف در حال کار بر روی نسخه اصلاح شده واکسن است که برای انواع جدید طراحی شده است و آنها قصد دارند ظرفیت تولید CoviVac را دو برابر کنند و به 2.5 میلیون دوز در ماه برسانند. او بعداً گفت که مرکز چوماکوف میتواند 20 میلیون دوز در سال 2022 تولید کند. مدیر در اکتبر به تاس گفت که آزمایشی برای بزرگسالان 60 سال و بالاتر میتواند به زودی آغاز شود. در 18 نوامبر، تاس گزارش داد که چوماکوف همچنین در حال توسعه دو واکسن بر اساس سویه دلتا است. Chumakov تاییدیه شروع آزمایشات فاز 3 در کودکان را در 7 فوریه 2022 دریافت کرد. به گفته مدیر مرکز Chumakov، CoviVac حدود 62 درصد در برابر نوع Omicron موثر است.
استفاده زودهنگام در: روسیه.
Updated Feb. 8در تاریخ 18 آگوست ، رئیس اپیدمیولوژی وزارت بهداشت عمومی کوبا از اولین آزمایش آزمایش واکسن Covid-19 در این کشور خبر داد. موسسه واکسن Finlay در هاوانا آزمایش واکسنی به نام Soberana 1. را آغاز کرد. این ماده حاوی بخشی از پروتئین سنبله به نام RBD به همراه دو ماده اضافی است: پروتئین های باکتری و هیدروکسید آلومینیوم. این مواد ، که به عنوان کمکی شناخته می شوند ، پاسخ سیستم ایمنی بدن به ویروس کرونا را افزایش می دهند.
در 26 جولای، رسانه های کوبا گزارش دادند که Soberana 1 وارد فاز 2 آزمایشی شده است.
در ماه نوامبر، مقامات بهداشتی کوبا آزمایش بالینی را برای استفاده از Soberana 1 به عنوان دوز تقویت کننده تایید کردند. نتایج حاصل از آزمایش فاز 1 نشان می دهد که Soberana 1 می تواند به طور ایمن ایمنی ایجاد کند، و در صورت ترکیب با Abdala، می تواند با نوع Omicron مبارزه کند.
واکسن سازنده فرانسوی Valneva با استفاده از مواد کمکی از Dynavax واکسنی را از ویروس های کرونا ویروس غیرفعال شیمیایی ایجاد کرد. این واکسن که VLA2001 نام دارد ، در حال حاضر تنها واکسن ویروس غیرفعال است که در اروپا تولید می شود. در 16 دسامبر ، والنووا یک مرحله آزمایشی مرحله 2/1 را در انگلستان آغاز کرد. در 7 آوریل ، این شرکت اعلام کرد که این آزمایش نتایج مثبتی داشته و در آستانه آزمایش آزمایشی فاز 3 خود در پایان ماه است. این شرکت امیدوار است که در نیمه دوم سال 2021 مجوز کسب دهد. دولت انگلیس در حال حاضر به توافق رسیده است که 100 میلیون دوز واکسن را در صورت ایمن و موثر بودن خریداری کند ، با گزینه ای برای خرید 90 میلیون بیشتر.
Updated April 11Codagenix مستقر در نیویورک واکسنهایی را براساس ویروسهای زنده ضعیف شده تولید می کند ، اما با یک پیچ و تاب: آنها ویروس ها را از ابتدا ایجاد می کنند. محققان با معرفی صدها جهش ، ژنوم ویروس ها را بازنویسی می کنند. سپس مولکول های RNA را رمزگذاری می کنند که ژن های بازنویسی شده را رمزگذاری می کنند. در سلولهای میزبان ویژه ، مولکولها می توانند ویروسهای کامل ایجاد کنند. اما به لطف جهش های بیشمار ، آنها بسیار ضعیف هستند و در هنگام تزریق واکسن نمی توانند باعث ایجاد Covid-19 شوند. پس از آزمایش های موفقیت آمیز روی حیوانات ، آزمایش فاز 1 در ژانویه در انگلستان آغاز شد.
Codagenix در 22 سپتامبر اعلام کرد که نتایج امیدوارکنندهای از آزمایش به دست آورده و به سمت آزمایش فاز 2/3 حرکت میکند. اما این آزمایشات پیشرفته هنوز شروع نشده است.
در فوریه 2022، Codagenix فاز 1 آزمایش جدیدی را ثبت کرد و این بار واکسن خود را به عنوان یک تقویت کننده آزمایش کرد.
Updated Feb. 11
Providence Therapeutics کانادا در واکسن های RNA پیام رسان برای درمان سرطان تخصص دارد. در واکنش به همه گیری ، آنها واکسن mRNA علیه کروناویروس تولید کردند. آنها مطالعه فاز 1 واکسن RNA را در اواخر ژانویه 2021 آغاز کردند و در ماه مه اعلام کردند که واکسن سالم به نظر می رسد و سطوح امیدوار کننده ای از آنتی بادی ها تولید می کند. در ماه ژوئن ، این شرکت با سازنده واکسن هندی Biological E برای انجام آزمایشات پیشرفته در هند به توافق رسید. Biological E با خرید حداکثر 30 میلیون دوز موافقت کرد و برنامه ریزی کرد تولید واکسن خود را به بیش از یک میلیارد دوز در سال 2022 برساند.
Updated Aug. 4
تولید کننده واکسن کره جنوبی EuBiologics آزمایش فاز 1/2 واکسن مبتنی بر پروتئین را در اواخر ژانویه آغاز کرد. این واکسن که با نام EuCorVac-19 شناخته می شود ، پروتئین سنبله را با یک ماده کمکی ترکیب می کند که سیستم ایمنی بدن را تحریک می کند. EuBiologics در 10 ژوئن 2021 اعلام کرد که مرحله 1 را با موفقیت به پایان رساند.
در 17 سپتامبر، آنها تزریق واکسن را برای داوطلبان فاز 2 به پایان رساندند و برنامههایی را برای آزمایش فاز 3 طراحی کردند که در آن آنها آن را با واکسن AstraZeneca، Vaxzevria مقایسه میکردند. اما نشریه کره ای بیومدیکال ریویو گزارش داد که آسترازنکا واکسن را تامین نخواهد کرد و این امر باعث ایجاد شک و تردید در مورد چشم انداز آزمایشی شده است. با این حال، در 28 ژانویه 2022، EuBiologics اعلام کرد که مجوز دولت کره جنوبی را برای ادامه آزمایشات فاز 3 دریافت کرده است.


Takis Biotech و Rottapharm Biotech ، دو شرکت واکسن سازی در ایتالیا ، واکسنی به نام COVID-eVax تولید کردند. یک دستگاه خاص از یک نبض الکتریکی کوچک برای انتقال DNA از طریق پوست استفاده می کند. DNA وارد سلول هایی می شود که از دستورالعمل های ژنتیکی برای ساختن پروتئین های سنبله ای استفاده می کنند. در ماه فوریه ، تاکیس و روتافرم یک محاکمه فاز 1/2 را آغاز کردند. COVID-eVax می تواند در دمای اتاق ثابت بماند.
در ماه سپتامبر، این شرکتها بیانیهای مطبوعاتی منتشر کردند که در آن بیان شد که آزمایش فاز 1 نتایج امیدوارکنندهای را ارائه کرد. در آن زمان، نرخ واکسیناسیون ایتالیا به حدی افزایش یافته بود که شرکتها گفتند جذب داوطلبان کافی برای انتقال به مرحله آزمایشی فاز 2 دشوار است.

محققان BioNet-Asia و Technovalia مستقر در استرالیا با استفاده از یک سیستم زایمان از PharmaJet ، یک واکسن DNA به نام COVIGEN تولید کرده اند که می تواند بدون سوزن از طریق پوست تحت فشار قرار گیرد. در عوض ، دوز در دستگاه دستی بارگیری می شود و مستقیماً از طریق جت پاشش مایع به داخل بافت سلول شلیک می شود. واکسن های آنفولانزا از این دستگاه استفاده می کنند که به گفته فارماژت جایگزین ایمن تری برای تزریق سوزن است. محققان یک آزمایش فاز 1 را در 8 فوریه در استرالیا ثبت کردند و بر اساس تغییر جدیدی در سابقه کارآزمایی انجام شده در 11 ژانویه 2022، مطالعه در حال انجام را در اواخر ژوئن آغاز کردند.
Updated Jan. 18
در 11 فوریه ، تنظیم کننده های هند به بهارات بیوتک اجازه دادند آزمایش فاز 1 واکسنی را که به عنوان اسپری بینی تحویل داده شده است ، راه اندازی کند. این اسپری که BBV154 نام دارد حاوی آدنو ویروس شامپانزه است که توسط محققان دانشگاه واشنگتن ساخته شده است. آنها دریافتند که می تواند آنتی بادی ویروس کرونا را فقط با یک دوز در موش تولید کند. BBV154 دومین اقدام Bharat Biotech در آزمایشات بالینی واکسن ویروس کرونا است. واکسن آنها کوواکسین ، ساخته شده از ویروس های غیرفعال ، در حال حاضر در هند مورد استفاده اضطراری قرار دارد.
Updated Feb. 16



در سال 2020، محققان دانشکده پزشکی Icahn در کوه سینا در نیویورک واکسن کووید-19 را بر اساس ویروسی به نام ویروس بیماری نیوکاسل یا به اختصار NDV ساختند. NDV یک پاتوژن پرندگان است و در انسان علائمی ایجاد نمی کند. محققان NDV را برای حمل ژن نسخه اصلاح شده پروتئین اسپایک کروناویروس به نام HexaPro که در دانشگاه تگزاس توسعه یافته است، مهندسی کردند. آنها سپس ویروس اصلاح شده را در تخم مرغ رشد دادند. محققان NDV ها را با مواد شیمیایی غیرفعال کردند و آنها را با مواد شیمیایی تقویت کننده سیستم ایمنی به نام ادجوانت ترکیب کردند. محققان دریافتند واکسنی که NDV-HXP-S نام دارد، سطوح بالایی از آنتی بادی های کروناویروس را در موش ها و همسترها تولید می کند. آنها نتایج آزمایشات خود را در ماه نوامبر منتشر کردند.
NDV-HXP-S به طور بالقوه می تواند به کشورهای با درآمد کم تا متوسط کمک کند تا منابع خود را از واکسن کووید-19 تامین کنند. ویروس بیماری نیوکاسل را می توان به طور ایمن در مقادیر زیاد در تخم مرغ رشد داد، همان روشی که واکسن آنفولانزا از دهه 1950 تولید شده است. در نتیجه ساخت این واکسن بسیار ارزان است.
این مزایا مورد توجه چهار کشور قرار گرفت که همگی مجوز واکسن را صادر کردند و آزمایشهایی را آغاز کردند. در تایلند، دانشگاه ماهیدول و سازمان دارویی دولتی، یک تولیدکننده داروی دولتی مجوز واکسن را صادر کرد و آزمایشات بالینی را در فوریه 2021 راه اندازی کرد. نتایج آزمایش فاز 1 نشان داد که واکسن پروفایل ایمنی قابل قبولی را نشان داد و سطوح امیدوارکننده ای از آنتی بادی ها را تولید کرد. فاز 2 آزمایشی در ماه اوت آغاز شد.
Avi-Mex در مکزیک نیز مجوز NDV-HXP-S را با نام Patria صادر کرد. نسخه آن ها از واکسن به صورت اسپری بینی تحویل داده می شود که در مرحله آزمایشی فاز 2 آن را آزمایش می کنند. نتایج اولیه از مرحله اول که در فوریه 2022 منتشر شد، نشان می دهد که واکسن بی خطر است. در ماه ژوئن، موسسه بوتانتان برزیل آزمایش فاز 1 واکسن را که در آنجا به نام بوتانواک شناخته می شود، راه اندازی کرد. در نوامبر 2021، مجله برزیلی O Globo گزارش داد که انتظار می رود Butanvac در سال 2022 در برزیل توزیع شود.
در همین حال، مؤسسه واکسنها و بیولوژیکهای پزشکی در ویتنام آزمایشهای خود را با نام واکسن Covivac آغاز کرد. در ماه اوت آنها به مرحله آزمایشی فاز 2 پیش رفتند. در ژانویه 2022، این موسسه اعلام کرد که واکسن بی خطر بوده و سطوح آنتی بادی بهتری نسبت به واکسن AstraZeneca تولید می کند. اما موسسه تصمیم گرفته است که Covivac را به فاز 3 پیش نبرد.
Updated Feb. 15

Gritstone bio در سالهای اخیر واکسنهای آزمایشی ایجاد کرده است که به سیستم ایمنی حمله به تومورها را آموزش میدهد. در سال 2020، آنها واکسنی برای کووید-19 ساختند که تعدادی از اهداف در ویروس کرونا را برای حمله سیستم ایمنی ارائه می کند.
محققان قطعهای از DNA ساختند که کل پروتئین اسپایک ویروس کرونا را رمزگذاری میکند. علاوه بر این، دستورالعمل هایی را برای ساخت قطعات کوچک دیگر پروتئین های ویروسی به نام نوکلئوکپسید و ORF3a رمزگذاری می کند. آنها سپس این کاست را در ژن های یک آدنوویروس شامپانزه قرار دادند. پروتئین سنبله بدن را تحریک می کند تا آنتی بادی بسازد، در حالی که قطعات پروتئین های دیگر سیستم ایمنی را آموزش می دهند تا سلول های عفونی را شناسایی کند و آنها را بکشد.
علاوه بر این، محققان یک مولکول RNA با همان دستورالعمل های ژنتیکی ایجاد کردند که آن را در یک پوسته قرار دادند. هنگامی که پوسته به داخل سلول می لغزد، مولکول RNA می تواند از خود کپی بسازد و سلول سپس از آن نسخه ها پروتئین می سازد.
در فاز 1 آزمایشی که در مارس 2021 راه اندازی شد، مؤسسه ملی آلرژی و بیماری های عفونی در حال آزمایش این است که این دو واکسن چقدر با هم کار می کنند، آدنوویروس شامپانزه به عنوان دوز اول و mRNA خود تقویت کننده به عنوان دومین دوز عمل می کند. محققان امیدوارند که این ترکیب پاسخ ایمنی بهتری نسبت به دو دوز از هر دو واکسن ایجاد کند.
Updated Jan. 12

بهار گذشته، محققان دانشگاه واشنگتن نانوذرهای را ساختند که با تکههایی از پروتئین اسپایک ویروس کرونا پوشانده شده بود. آزمایشات روی موش ها پاسخ ایمنی قوی را نشان داد. شرکت واکسن کره جنوبی SK Bioscience مجوز این واکسن به نام GBP510 را صادر کرد. پس از همکاری با GSK، آنها فاز 1/2 آزمایش واکسن را در فوریه 2021 راه اندازی کردند. اخبار مهندسی ژنتیک و بیوتکنولوژی گزارش دادند که افرادی که واکسن را دریافت کردند، 5 تا 8 برابر بیشتر از افرادی که از کووید-19 بهبود یافته بودند، آنتی بادی تولید کردند. SK Bioscience 210.1 میلیون دلار از ائتلاف نوآوری های آمادگی همه گیر برای توسعه GBP510 دریافت کرده است. در ماه اوت، این شرکت فاز 3 آزمایشی را راه اندازی کرد و GBP510 را با واکسن Vaxzevria AstraZeneca مقایسه کرد. SK Bioscience انتظار نتایج را در نیمه اول سال 2022 دارد. در 21 دسامبر، CEPI 50 میلیون دلار دیگر را به SK Bioscience متعهد کرد تا یک واکسن "ضد نوع" بر اساس GBP510 ایجاد کند.
Updated Dec. 22
شرکت VBI Vaccines مستقر در ماساچوست واکسن ویروس کرونا تولید کرد که بر پایه پوسته های پروتئینی توخالی و ویروسی ساخته شده است. این شرکت قطعاتی از پروتئین های ویروس کرونا را به پوسته ها اضافه کرد که برای پتانسیل آنها هم برای تولید آنتی بادی و هم برای آموزش سلولهای T برای حمله به سلولهای آلوده انتخاب شده است. در فوریه 2021 ، VBI با مقایسه اثرات استفاده از یک یا دو دوز ، یک آزمایش فاز 1/2 کنترل شده با دارونما را در کانادا ثبت کرد. در این واکسن که VBI-2902a نام دارد ، از فسفات آلومینیوم به عنوان کمکی استفاده می شود. در 29 ژوئن ، VBI نتایج اولیه این آزمایش را منتشر کرد ، که نشان می دهد داوطلبان سطح بالایی از آنتی بادی ها را تولید می کنند بدون هیچ عارضه جانبی جدی.
واکسن های VBI همچنین در حال آزمایش واکسن هایی هستند که پروتئین های سه ویروس کرونا را ترکیب می کنند و باعث بیماری شدید در انسان می شوند: Covid-19 ، SARS و MERS. آنها در حال بررسی این احتمال هستند که چنین واکسنی روزی بتواند در برابر ویروس های کرونا ویروس محافظت کند ، از جمله آنهایی که هنوز از میزبان حیوانات نریخته اند.
Updated Oct. 4
به عنوان بخشی از کنسرسیوم PREVENT-nCoV که توسط اتحادیه اروپا تأمین می شود ، تیمی از شرکت های بیوتکنولوژی و آزمایشگاه های تحقیقاتی واکسنی علیه Covid-19 تولید کردند. این ماده حاوی یک پروتئین ویروس کرونا است که نوکلئو کپسید نامیده می شود. این واکسن که ABNCoV2 نام دارد ، از فناوری اعضای کنسرسیوم AdaptVac و ExpreS2ion و غیره استفاده می کند. باواریای نوردیک پس از وعده نتایج پیش بالینی در پستانداران بزرگ ، اعلام کرد که آزمایش آزمایشی مرحله 2/1 واکسن را در هلند ادامه خواهد داد. اولین داوطلبان دوز واکسن را در 15 مارس دریافت کردند.
در 9 آگوست، محققان گفتند که آزمایش نشان داد ABNCoV2 سطوح بالایی از آنتی بادی ها را بدون عوارض جانبی خطرناک تولید می کند. اواخر همان ماه، باواریا نوردیک آزمایشات فاز 2 واکسن را هم به عنوان محافظت اولیه در برابر کووید-19 و هم به عنوان تقویت کننده سایر واکسن ها راه اندازی کرد. نتایج مثبت حاصل از کارآزمایی که در 5 دسامبر منتشر شد، نشان می دهد که واکسن به عنوان یک تقویت کننده موثر است. باواریای نوردیک انتظار دارد این واکسن را در سال 2022 به مرحله آزمایشی فاز 3 برساند.
SK Bioscience ، سازنده واکسن کره جنوبی ، در 23 نوامبر از وزارت بهداشت غذا و دارو در کشور برای واکسنی به نام NBP2001 تأیید کرد. این واکسن حاوی قطعاتی از پروتئین سنبله بود. در یک آزمایش فاز 1 ، محققان اکنون واکسن را روی 50 داوطلب آزمایش می کنند.
Updated Feb. 23
علاوه بر واکسن عبدالا ، مرکز مهندسی ژنتیک و بیوتکنولوژی کوبا در 26 نوامبر 2020 اعلام کرد که آزمایش مرحله دوم واکسن دوم را آغاز می کند ، این واکسن به عنوان اسپری بینی ارائه می شود. واکسن معروف به Mambisa ، حاوی قطعه ای از پروتئین سنبله کروناویروس به نام دامنه اتصال گیرنده ، همراه با پروتئینی از ویروس هپاتیت B است که سیستم ایمنی بدن را تحریک می کند. این نام به زنانی اطلاق می شود که در جنگ های استقلال کوبا در قرن نوزدهم جنگیدند. مامبیسا یکی از دو واکسن کوبائی است که در آزمایش بالینی فاز 1/2 مورد آزمایش قرار گرفته است تا توانایی آنها در افزایش ایمنی در افرادی که قبلاً به کووید -19 مبتلا بوده اند مورد ارزیابی قرار گیرد.
آن آزمایش در نوامبر به فاز 2 منتقل شد. پس از انتشار نتایج امیدوارکننده از آزمایش، محققان در ژانویه 2022 اعلام کردند که ارزیابی واکسن را در آزمایشات انسانی ادامه خواهند داد. مقامات بهداشتی کوبا آزمایشی را برای مامبیسا به عنوان دوز تقویت کننده در 20 نوامبر تأیید کردند.


محققان مستقر در ژاپن در Daiichi Sankyo با همکاری دانشگاه توکیو واکسن mRNA علیه ویروس کرونا تولید کرده اند. آنها آزمایش فاز 1/2 واکسن را با نام DS-5670 در 22 مارس آغاز کردند.
Updated March 23
واکسن های Meissa واکسنی تولید کرده اند که می تواند به صورت اسپری یا قطره ای در بینی منتقل شود. برای ساخت واکسن ، محققان ویروس دیگری به نام ویروس متناوب تنفسی (به اختصار RSV) را شروع کردند. محققان جهش هایی را در ژن های ویروس RSV وارد کردند به گونه ای که برای ایجاد بیماری بسیار آهسته تکثیر می شود.
سپس آنها ژنی را برای پروتئین سنبله ویروس کرونا اضافه کردند تا ویروسهای ضعیف RSV بتوانند آن را به سیستم ایمنی بدن ارائه دهند.
مطالعهای روی میمونهایی که در ژوئیه ۲۰۲۱ منتشر شد که نشان داد این واکسن میتواند پادتنهایی در بینی حیوانات تولید کند و از آنها در برابر کووید-۱۹ محافظت کند.
دادههای اولیه از آزمایش فاز 1، که در 28 اکتبر اعلام شد، نشان میدهد که این واکسن همچنین میتواند سطوح بالایی از آنتیبادیها علیه ویروس کرونا را در بینی افراد تولید کند.
نتایج کامل این آزمایش در سال 2022 منتشر خواهد شد.

شرکت Akston Biosciences مستقر در ماساچوست واکسنی ساخته است که بخشی از پروتئین اسپایک ویروس کرونا به نام دامنه اتصال گیرنده را هدف قرار می دهد. محققان آکستون می گویند که تمرکز بر این بخش روشی کارآمد برای تقویت ایمنی در برابر انواع جدید است. آنها آزمایش فاز 1/2 واکسن خود، معروف به AKS-452 را در 12 آوریل آغاز کردند. پس از نتایج مثبت از آزمایش فاز 1، آکستون اعلام کرد که دوز شرکت کنندگان در آزمایش فاز 2 خود را در 5 اوت آغاز کرده است. در تاریخ نوامبر. 20، این شرکت گفت که 100 بیمار اول را در فاز 2 آزمایش دیگری در هند دوز مصرف کرده است. نتایج مثبت حاصل از کارآزمایی که در 22 دسامبر منتشر شد، نشان داد که واکسن میتواند پاسخ ایمنی قابل توجهی را بدون واکنشهای جانبی ایجاد کند. آنها قصد دارند این مطالعه را به مرحله 2/3 آزمایشی با 1500 داوطلب در سال 2022 گسترش دهند.
Updated Feb. 8
دانشمندان Jiangsu Rec-Biotechnology واکسنی به نام ReCOV ساخته اند که از پروتئین های ویروسی ساخته شده در سلول های تخمدان همستر چینی ساخته می شود. آنها در 26 مارس یک آزمایش فاز 1 را در نیوزیلند ثبت کردند.
نتایج اولیه آزمایش نشان می دهد که واکسن در ایجاد ایمنی موثر بوده است. در 29 سپتامبر، Jiangsu اعلام کرد که با Shenzhen Rhegen Biotechnology ادغام خواهد شد تا به یک شرکت جدید به نام Wuhan Rhecogen Biotechnology تبدیل شود. این شرکت فاز 2/3 آزمایشی را در اواخر سال 2021 ثبت کرد و در ژانویه 2022 اعلام کرد که آزمایش برای شروع در فیلیپین تأیید شده است.

دانشمندان در موسسه تحقیقات ارتش والتر رید واکسنی از نانوذره تزئین شده با پروتئین سنبله ویروس کرونا ساخته اند. آزمایشات روی میمون ها نشان داد که واکسن دو دوزه آنتی بادی های بسیار بالایی را تحویل می دهد. در 5 آوریل ، ارتش آزمایش فاز 1 را آغاز کرد. طراحان واکسن امیدوارند که بتوانند نسخه جدیدی از واکسن را با پروتئین های ویروس های مختلف کرونا ایجاد کنند تا از محافظتی فراتر از Covid-19 استفاده کنند.
در ماه دسامبر، DefenceOne گزارش داد که محققان فاز 1 آزمایشی را تکمیل کرده اند.

در 22 مارس ، KM Biologics ژاپن اعلام کرد که آزمایش فاز 1/2 از نامزد واکسن غیرفعال خود را با نام KD-414 آغاز کرده است. این شرکت همچنین در ساخت واکسن AstraZeneca نقش داشته است.
Updated May 7
وزارت دفاع ایران در تاریخ 25 اسفند 1390 از راه اندازی واکسن ساخته شده از کروناویروس های غیرفعال خبر داد. این واکسن که با نام فخرواک شناخته می شود، به نام محسن فخری زاده، دانشمند ارشد هسته ای ایران که در ماه نوامبر کشته شد، نامگذاری شد. پس از تکمیل فاز 1 آزمایشی، فخراچ در ماه ژوئن وارد مرحله آزمایشی فاز 2 شد. در سپتامبر قبل از اینکه مشخص شود واکسن چقدر موثر است مجوز استفاده اضطراری را دریافت کرد. اما در ماه اکتبر، ایران اعلام کرد که تولید فخرواک را کنار می گذارد زیرا ایرانیان به جای آن به واکسن های وارداتی روی آوردند. با این حال، در 1 نوامبر، تهران تایمز گزارش داد که واکسن مجوز استفاده اضطراری در ایران دریافت کرده است.
Updated Nov. 26
محققان ترک در Koçak Farma واکسنی ساخته شده از ویروس های کرونا ویروس غیرفعال ساخته اند. آنها دادگاه فاز 1 را در 8 آوریل آغاز کردند.
Updated April 9
محققان Elixirgen Therapeutics مستقر در بالتیمور یک واکسن RNA به نام EXG-5003 ساخته اند که قسمت کوچکی از پروتئین سنبله ویروس کرونا را هدف قرار می دهد. در ماه مه ، آنها آزمایش فاز 1/2 واکسن را در ژاپن آغاز کردند.
در 8 اکتبر، Elixirgen اعلام کرد که مجوز واکسن خود را به یک شرکت نامعلوم برای بازاریابی در سراسر جهان، به استثنای ژاپن، داده است.


محققان موسسه محصولات بیولوژیکی لانژو ، فناوری دارویی پکن ژونگ شنگ هنگ یی و دانشگاه ژنگ ژو واکسنی را آزمایش می کنند که در سلول های تخمدان همستر چینی رشد می کند. آنها در 3 مه آزمایش فاز 1/2 را ثبت کردند.
در ماه اکتبر آنها یک آزمایش فاز 3 را برای آزمایش واکسن خود به عنوان تقویت کننده واکسن ویروس غیرفعال ثبت کردند.

محققان چینی در Stemirna Therapeutics با همکاری بیمارستان شرق شانگهای واکسن mRNA تولید کرده اند. آنها دادگاه فاز 1 را در اول ماه مه ثبت کردند.
دانشمندان مرحله 1/2 آزمایش دیگری را در 3 دسامبر ثبت کردند.


در بهار 2021 ، محققان دانشگاه واشنگتن واکسن نانوذره برای Covid-19 تهیه کردند. هر نانوذره کپی های زیادی از یک قطعه پروتئین به نام RBD را از پروتئین سنبله ویروس کرونا حمل می کند. Icosavax مستقر در سیاتل مجوز آزمایش و بازاریابی واکسن را با نام IVX-411 از دانشگاه واشنگتن خریداری کرد. در 8 ژوئن ، این شرکت اعلام کرد که آزمایش فاز 1/2 را در استرالیا آغاز کرده است. در این محاکمه ، با حمایت مالی بنیاد بیل و ملیندا گیتس ، برخی از داوطلبان واکسن را بهمراه یک ماده کمکی از Seqirus دریافت می کنند. دانشمندان همچنین در حال آزمایش پتانسیل واکسن خود به عنوان یک تقویت کننده هستند.
نتایج آزمایش در نیمه اول سال 2022 پیش بینی می شود.


محققان VaxForm مستقر در پنسیلوانیا واکسنی ایجاد کرده اند که می تواند از طریق دهان به عنوان مایعات مصرف شود. دانشمندان می گویند که کاندیدای آنها ، CoV2-OGEN1 ، نسبت به واکسن های تزریقی دارای برتری است زیرا در دمای اتاق پایدار است و برای تجویز آن نیازی به پزشک متخصص نیست. Syneos Health و Formulations Specialty US یک آزمایش فاز 1 را در نیوزیلند در 19 مه 2021 ثبت کردند.
در ماه دسامبر، USSF گزارش داد که کارآزمایی نشان داد واکسن بی خطر است و باعث واکنش ایمنی قوی در همه داوطلبان شد. اکنون برنامه هایی برای آزمایش فاز 2/3 در حال انجام است.
Updated Dec. 31
محققان ایرانی در دانشگاه علوم پزشکی بقیه الله یک واکسن مبتنی بر پروتئین علیه ویروس کرونا تولید کردند. در 27 ژوئن ، سپاه پاسداران انقلاب اسلامی اعلام كرد كه واكسنی به نام نورا وارد آزمایشات فاز 1 شده است.
محققان فاز 2 آزمایشی را در 11 اکتبر ثبت کردند. رئیس دانشگاه علوم پزشکی بقیه الله در دسامبر گفت که 5 میلیون دوز از این واکسن تولید شده است.
نورا در 2 ژانویه وارد مرحله 3 محاکمه شد و یکی از فرماندهان سپاه پاسداران انقلاب اسلامی را به عنوان اولین شرکت کننده دوز کرد. تهران تایمز در 9 فوریه گزارش داد که نورا فاز 3 آزمایشی را تکمیل کرده است و منتظر مجوز استفاده اضطراری از دولت ایران است.

سه دهه پیش ، مرکز تحقیقات عفونی آلمان یک واکسن آبله را از یک ویروس بی خطر به نام Modified Vaccinia Ankara یا به اختصار MVA توسعه داد. در سال های اخیر ، آنها آن را برای ایجاد واکسن برای MERS ، بیماری ایجاد شده توسط ویروس کرونا دیگر ، سازگار کردند.
در بهار سال 2020 ، آنها یک واکسن مبتنی بر MVA برای SARS-CoV-2 ، ویروس کرونا که باعث همه گیری کووید 19 می شود ، ساختند. این ژن حاوی پروتئین سنبله است که در داخل سلولهایی که به آنها حمله می کند تولید می شود. در 29 سپتامبر ، مرکز و کنسرسیومی از دانشگاه های آلمان آزمایش فاز 1 را ثبت کردند. در ژانویه 2021 ، مرکز اعلام کرد که فرمول اولیه آنها نتایج ناامیدکننده ای را ارائه می دهد و محاکمه را به تعویق می اندازند تا آن را به روز کنند. آنها گفتند که آزمایش با نسخه به روز واکسن را در 16 ژوئیه 2021 از سر گرفتند.
محققان در ماه نوامبر اعلام کردند که در حال ارزیابی واکسن مبتنی بر MVA در آزمایشات فاز 1 به عنوان یک تقویت کننده و در افراد واکسینه نشده هستند. آنها دادگاه را در 7 فوریه 2022 ثبت کردند.

محققان داروسازی Tetherex مستقر در اوکلاهما واکسنی را ایجاد کرده اند که از ویروس های مهندسی ژنتیک شده برای ایجاد ایمنی استفاده می کند. آنها آزمایش فاز 1 را در 9 آوریل 2021 در استرالیا ثبت کردند.
کلینیک مایو در 6 ژوئیه قراردادی را برای توسعه و عرضه فناوری واکسن در سرتاسر جهان اعلام کرد. سخنگوی Tetherex در 18 ژانویه 2022 گفت که آزمایش همچنان ادامه دارد.

دانشمندان دانشگاه جورجیا و دانشگاه آیووا واکسنی را بر اساس ویروس پاراآنفولانزای سگ تهیه کرده اند که هرگز مشخص نشده است که باعث ایجاد بیماری در انسان می شود. آنها آن را برای حمل پروتئین های ویروس کرونا طراحی کردند. واکسن CVXGA1 نامیده می شود و به عنوان اسپری بینی تزریق می شود. در ژوئیه 2021 ، محققان مطالعه ای را منتشر کردند که نشان می داد یک دوز واحد واکسن می تواند موش ها و موش ها را در برابر Covid-19 محافظت کند.
یک شرکت فرعی به نام CyanVac واکسن داخل بینی به نام CVXGA1 را در همان ماه به مرحله آزمایشی فاز 1 برد و اولین شرکت کننده را در اواخر سپتامبر ثبت نام کرد.

محققان روسی در موسسه تحقیقات علمی سنت پترزبورگ واکسن ها و سرا در آژانس بیولوژیکی پزشکی فدرال واکسن زیر واحد پروتئینی را در برابر ویروس کرونا تولید کردند. TASS گزارش داد که آنها آزمایش فاز 1/2 را در 19 ژوئیه 2021 آغاز کردند.
Updated July 7
دانشمندان استارتاپ تایلندی Baiya Phytopharm واکسنی ساخته اند که از فناوری های گیاهی برای توسعه ایمنی استفاده می کند. آنها یک آزمایش فاز 1 را در 7 ژوئیه 2021 ثبت کردند و مطالعه را در سپتامبر آغاز کردند. در نوامبر، محققان گفتند که آزمایشات فاز 2 در حال انجام است.
Baiya همچنین در حال کار بر روی نسخه نسل دوم واکسن گیاهی خود برای رسیدگی به انواع آن است. به گفته محققان، فاز 1 آزمایشات بالینی ممکن است در اوایل سال 2022 انجام شود.
Updated Feb. 7

محققان چینی در شانگهای زرون بیوتکنولوژی و والواکس بیوتکنولوژی ساختار پروتئین اسپایک کروناویروس را برای تحریک بهتر پاسخ ایمنی از واکسن خود تغییر دادهاند. آنها یک آزمایش فاز 1 را برای نمونه اولیه واکسن خود به نام 202-CoV در 29 ژوئیه در چین ثبت کردند. در 4 اوت، آنها مرحله 2 آزمایشی را ثبت کردند. ZerunBio و Walvax در 21 ژوئیه اعلام کردند که آنها همچنین با CEPI، ائتلاف برای نوآوری های آمادگی همه گیر، برای حمایت از توسعه 202-CoV و ایجاد یک واکسن متفاوت با استفاده از همان فناوری، همکاری می کنند. CEPI همکاری خود را با این دو شرکت در 8 فوریه 2022 گسترش داد تا از آزمایش فاز 1/2 دیگری در آفریقا برای یک واکسن چند گونه پشتیبانی کند.
Updated Feb. 8فاز 2
نام واکسن: Comirnaty (همچنین به عنوان tozinameran یا BNT162b2 نیز شناخته می شود)
کارایی: 95٪
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
ذخیره سازی: ذخیره سازی فریزر فقط در –94 درجه فارنهایت (–70 درجه سانتیگراد)
سازمان بهداشت جهانی این واکسن را تایید کرده است.
در تاریخ 9 نوامبر ، Pfizer مستقر در نیویورک و شرکت آلمانی BioNTech با اعلام اینکه میزان اثر بخشی واکسن ویروس کرونا بیش از 90 درصد است ، بسیار فراتر از انتظار است ، تاریخ سازی کردند. این اولین باری بود که کسی چنین شواهدی را پیدا می کرد. بیش از یک ماه بعد ، در 11 دسامبر ، سازمان غذا و دارو اولین مجوز استفاده اضطراری را که ایالات متحده به واکسن ویروس کرونا داده است ، اعطا کرد. در 10 مه F.D.A. مجوز را برای کودکان 12 ساله گسترش داد.
کار بر روی واکسن در ژانویه سال 2020 آغاز شد ، زمانی که محققان BioNTech شروع به ساختن یک مولکول ژنتیکی به نام RNA پیام رسان (mRNA) کردند. آنها دستورالعمل های ژنتیکی ساخت پروتئین ویروس کرونا را ایجاد کردند ، معروف به سنبله. هنگامی که به سلول ها تزریق می شود ، واکسن باعث ایجاد پروتئین های سنبله ای می شود و سپس در بدن آزاد می شود و پاسخ سیستم ایمنی بدن را تحریک می کند. در ماه مارس ، BioNTech با همکاری Pfizer برای گسترش تحقیقات ، یک آزمایش بالینی را در ماه مه آغاز کرد. آنها به واکسن نام عمومی tozinameran و نام تجاری Comirnaty دادند
در آزمایشات فاز 1 ، محققان دریافتند که Comirnaty باعث تولید داوطلبان آنتی بادی علیه SARS-CoV-2 و همچنین سلولهای ایمنی به نام سلولهای T می شود که به ویروس پاسخ می دهند. در تاریخ 27 ژوئیه ، شرکت ها از آغاز آزمایش فاز 2/3 با حضور 30،000 داوطلب خبر دادند. در 12 سپتامبر ، Pfizer و BioNTech اعلام کردند که به دنبال گسترش دادگاه برای 44000 شرکت کننده هستند.
در طول تابستان و پاییز ، جهان توجه خود را بیشتر به محاکمه Pfizer-BioNTech معطوف کرد. در ماه سپتامبر ، دکتر آلبرت بورلا ، مدیر اجرایی Pfizer ، گفت که به محض ماه اکتبر ، آزمایش فاز 3 نتایج کافی را به دست می دهد تا نشان دهد که آیا واکسن م workedثر است یا خیر. پرزیدنت ترامپ با اشاره به وجود واکسن قبل از انتخابات ، پیشرفت آنها را تبلیغ کرد. اما در تاریخ 27 اکتبر ، دکتر بورلا اعلام کرد که داوطلبان حاضر در این آزمایش هنوز موارد کافی Covid-19 را برای تعیین کارایی واکسن ها تجربه نکرده اند. سرانجام ، در تاریخ 9 نوامبر ، Pfizer و BioNTech تجزیه و تحلیل اولیه خود را در مورد 94 مورد اول منتشر کردند.
طی یک ماه آینده ، Pfizer و BioNTech اطلاعات بیشتری در مورد موارد بیشتر منتشر کردند. در 8 دسامبر ، FDA تجزیه و تحلیل مستقل خود را از آزمایشات بالینی منتشر کرد. آنها تشخیص دادند که میزان Comirnaty 95 درصد است. در حالی که Comirnaty هیچ عارضه جانبی جدی ایجاد نکرد ، اما اغلب باعث خستگی کوتاه مدت ، تب و درد عضلانی می شود.
در تاریخ 2 دسامبر ، انگلستان مجوز اضطراری واکسن Pfizer و BioNTech را صادر کرد و در پی آن کشور های بیشتری به آن واگذار شدند. در تاریخ 31 دسامبر ، سازمان بهداشت جهانی واکسن را لیست استفاده اضطراری قرار داد ، که به سرعت مجوز آن در سراسر جهان سرعت می بخشد. در اسرائیل ، که پیشتاز واکسیناسیون دسته جمعی بود ، محققان دریافتند که این واکسن در دنیای واقعی همانطور که آزمایشات نشان داده است ، م wasثر است. مطالعه منتشر شده توسط مراکز کنترل بیماری در ماه مارس نشان داد که این واکسن بعد از دوز دوم 3/91٪ موثر است. در 7 مه ، Pfizer و BioNTech اعلام کردند که به دنبال F.D.A کامل هستند. تأیید واکسن آنها انتظار می رود روند این کار چند ماه طول بکشد.
با پیشرفت آزمایش ها ، Pfizer و BioNTech همچنین کارخانه های تولید Comirnaty را در مقادیر زیاد افزایش دادند. دولت ترامپ برای اطمینان از عرضه پیش از آن ، در ژوئیه 2020 به 100 میلیون دوز قرارداد 1.9 میلیارد دلاری به Pfizer و BioNTech اعطا کرد ، اما روزنامه نیویورک تایمز در ماه دسامبر گزارش داد که دولت این فرصت را در تابستان برای تأمین 100 میلیون دوز دیگر به دست آورد. . از آن زمان به بعد ، دولت های ترامپ و بایدن توافقاتی را برای مجموع 300 میلیون دوز تا تابستان به دست آوردند. در آوریل 2021 ، اتحادیه اروپا برای معامله 1.8 میلیارد دوز مذاکره کرد ، که باید کمبود بزرگی را که در اوایل انتشار واکسن تجربه کردند ، کاهش دهد. در کل ، BioNTech و Pfizer انتظار دارند در سال 2021 نزدیک به 3 میلیارد دوز تولید کنند.
در حالی که Comirnaty بسیار م provenثر بوده است ، در ابتدا توزیع این واکسن چالش برانگیز بود زیرا باید در دمای 94- درجه فارنهایت (70- درجه سانتیگراد) منجمد نگه داشته می شد. در 19 فوریه ، Pfizer و BioNTech اعلام کردند که می توانند واکسن را در دمای 25- تا 15- درجه سانتیگراد (-13 درجه فارنهایت تا 5 درجه فارنهایت) پایدار نگه دارند.
در ژانویه ، دانشمندان در مورد ظهور انواع سریع گسترش یافته که ممکن است قادر به فرار از آنتی بادی ها باشند ، نگران شدند. مطالعه ای که در ماه مه منتشر شد ، نشان داد كه Comirnaty در برابر برخی از انواع تا حدودی م effectiveثر است ، اما با این وجود محافظت شدیدی دارد. تحقیقات بعدی همچنین نشان داد که Pfizer از محافظت خوبی در برابر Delta ، گونه ای که برای اولین بار در هند شناسایی شد ، برخوردار است.
Comirnaty در حال حاضر در تعدادی آزمایش دیگر مورد آزمایش قرار گرفته است. در فوریه 2021 ، شرکت ها مطالعه ای را برای توسعه یک تقویت کننده خاص بتا اعلام کردند. آنها همچنین یک آزمایش به طور خاص برای زنان باردار و همچنین کودکان بین 5 تا 11 سال دارند. در 30 ژوئن ، پس از نتایج مثبت از محاکمه جوانان ، فایزر گفت که تصویب تصویب اضطراری برای استفاده در کودکان از همان اوایل سپتامبر. در ماه ژوئن ، محققان در آکسفورد نتایج اولیه را اعلام کردند که ترکیبی از واکسن AstraZeneca و به دنبال آن Comirnaty ، مقادیر زیادی آنتی بادی تولید می کند.
دکتر بورلا ، رئیس اجرایی ، گفت که افراد "احتمالاً" طی یک سال از دریافت دو دوز به یک واکسن اضافی نیاز دارند. Pfizer در ژوئن یک آزمایش برای ترکیب یک تقویت کننده با واکسن Prevnar ، برای بیماری پنوموکوک ، آغاز کرد.
مصوب برای استفاده در: بحرین ، برزیل ، نیوزیلند ، عربستان سعودی ، سوئیس.
استفاده اضطراری در: آرژانتین ، استرالیا ، بنگلادش ، برمودا ، بوتسوانا ، برونئی ، کابو ورد NEW ، کانادا ، شیلی ، کلمبیا ، کاستاریکا ، اکوادور ، اتحادیه اروپا ، گرینلند ، گواتمالا ، هنگ کنگ ، ایسلند ، عراق ، اسرائیل ، ژاپن ، اردن ، کویت ، لبنان ، لیبی NEW ، لیختن اشتاین ، مالزی ، مالدیو ، مکزیک ، مولداوی ، موناکو ، مغولستان ، نروژ ، مقدونیه شمالی ، عمان ، پاکستان ، پاناما ، پرو ، فیلیپین ، قطر ، سنت وینسنت و گرنادین های جدید ، صربستان ، سنگاپور ، سریلانکا ، آفریقای جنوبی ، کره جنوبی ، سنت مارتن ، تونس ، ترکیه ، اوکراین ، امارات متحده عربی ، انگلستان ، ایالات متحده ، اروگوئه ، ویتنام NEW. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی. برای استفاده اضطراری توسط سیستم تنظیم مقررات کارائیب توصیه می شود.
نام واکسن: AG0302-COVID19
کارایی: ناشناخته
دوز: 2 دوز ، با فاصله 2 هفته
نوع: تزریق پوست
ذخیره سازی: بیش از یک سال در دمای اتاق
در تاریخ 30 ژوئن ، شرکت بیوتکنولوژی ژاپنی AnGes آزمایش فاز 1 را برای آزمایش واکسن مبتنی بر DNA آغاز کرد که با همکاری دانشگاه اوزاکا و تاکارا بیو ساخته شده است. این شرکت در ماه دسامبر به محاکمه فاز 2/3 منتقل شد.
در 6 آگوست 2021، محققان فاز 1/2 آزمایش جدیدی از واکسن را با دوز بالاتر ثبت کردند، پس از اینکه نتایج اولیه نشان داد که اثربخشی برنامه دوز اولیه کافی نیست.
در 25 نوامبر، AnGes بیانیهای منتشر کرد که در آن گزارشهایی مبنی بر اینکه پیشرفت در ساخت واکسن را کنار گذاشته بود، رد کرد. اگرچه توانایی نامزد برای تولید آنتی بادی ناامید کننده بوده است، اما آزمایشات ادامه خواهد یافت.
در بهار سال 2020، موسسه تحقیقات بیولوژیکی اسرائیل کار بر روی واکسن کروناویروس مبتنی بر ویروس های استوماتیت تاولی را آغاز کرد. آنها این ویروس ها را برای حمل ژن پروتئین اسپایک ویروس کرونا مهندسی کردند. در 25 اکتبر، دولت اسرائیل اعلام کرد که واکسنی که Brilife نام دارد، در مرحله آزمایشی مرحله 1 قرار خواهد گرفت. در ژانویه 2021، واکسن به مرحله آزمایشی فاز 2 رفت. در ماه ژوئیه، اسرائیل با شرکت آمریکایی NRx Pharmaceuticals برای پیشبرد تحقیقات در مورد Brilife در مطالعاتی که قرار است در اسرائیل، گرجستان و اوکراین انجام شود، مشارکت کرد. ماه بعد، NRx مرحله 2/3 آزمایشی را با برنامه هایی برای جذب 550 داوطلب ثبت کرد. NRx در حال برنامهریزی برای انجام آزمایشهای دیگری در ماههای آینده است که اثربخشی Brilife را بهعنوان یک تقویتکننده و بهعنوان تزریقی که از طریق سیستم میکروسوزن انجام میشود، ارزیابی میکند. در 27 ژانویه، NRx گفت که واکسن ویروس Brilife ممکن است برخی از جهشهای نوع Omicron را به دست آورده باشد که به ایجاد ایمنی در شرکتکنندگان در آزمایش کمک میکند.
Updated Jan. 28نام واکسن: INO-4800
کارایی: ناشناخته
دوز: مشخص شود
نوع: تزریق پوست
ذخیره سازی: بیش از یک سال در دمای اتاق
قبل از همه گیری ، شرکت پنسیلوانیا اینوویو واکسن های مبتنی بر DNA تولید کرد که از طریق یک دستگاه دستی با پالس های الکتریکی به پوست منتقل می شود. آنها در حال انجام آزمایشات بالینی برای واکسن علیه تعدادی از بیماری ها از جمله HIV ، Zika و انواع مختلف سرطان هستند. در ابتدای بیماری همه گیر ، اینوویو یک واکسن DNA علیه پروتئین سنبله در ویروس کرونا تولید کرد. یک آزمایش فاز 1 ، منتشر شده در دسامبر ، هیچ عوارض جانبی جدی را کشف نکرد ، و پاسخ ایمنی را در 38 داوطلب اندازه گیری کرد.
اینوویو درگیر چندین دادخواست با سهامداران و یک شریک شرکت شد. در 28 سپتامبر ، F.D.A. به دلیل س questionsال در مورد دستگاه زایمان ، واکسن را تا حدی نگه دارید. در 16 نوامبر ، اینوویو گفت که F.D.A. به آنها اجازه داده بود که جلو بروند.
اینوویو آزمایشات فاز 2 خود را در ایالات متحده و همچنین چین و کره جنوبی ادامه داد و نتایج مطالعات را در 7 مه 2021 به صورت آنلاین ارسال کرد. آنها همچنین آزمایش نسخه های واکسن خود را که متناسب با انواع جدید است ، آغاز کردند.
پس از از دست دادن بودجه دولت برای آزمایشات فاز 3 ، اینوویو گفت که آزمایش واکسن خود را در خارج از ایالات متحده ادامه خواهد داد. در 8 ژوئن ، این شرکت اعلام کرد که با مشارکت شرکت چینی Advaccine Biopharmaceuticals ، آزمایشات فاز 3 خود را در آمریکای لاتین و آسیا اجرا می کند.
Updated June 8شرکت کالیفرنیایی Arcturus Therapeutics و دانشکده پزشکی Duke-NUS در سنگاپور یک واکسن mRNA به نام ARCT-021 تولید کرده اند. دارای طراحی "خود تکرار کننده" است که منجر به تولید بیشتر پروتئین های ویروسی می شود. آزمایش روی حیوانات نشان داد که آنها را در برابر عفونت محافظت می کند. در آگوست ، Arcturus مرحله 1/2 آزمایش را در بیمارستان عمومی سنگاپور آغاز کرد. در 9 نوامبر ، این شرکت اعلام کرد که تجزیه و تحلیل موقت آزمایش نشان داد که واکسن یک پاسخ ایمنی ایجاد می کند که در طیف وسیعی از پاسخ هایی است که در افرادی که از کووید -19 بهبود یافته اند دیده می شود. در 6 ژانویه Arcturus اعلام کرد که آنها اجازه دارند مرحله دوم محاکمه را در سنگاپور و ایالات متحده آغاز کنند. سنگاپور با Arcturus به توافق رسید تا 175 میلیون دلار برای تهیه واکسن در زمان آماده شدن هزینه کند.
در 2 آگوست ، Arcturus گفت که برای آغاز آزمایشات واکسن mRNA نسل بعدی خود در ویتنام تأیید شده است. این واکسن به موازات ARCT-021 تولید می شود.
Updated Aug. 2شرکت کره جنوبی ژنکسین آزمایش ایمنی واکسن مبتنی بر DNA را در ژوئن 2020 آغاز کرد. در ماه دسامبر ، کره بیومدیکال ریویو گزارش داد که ژنکسین از فرمول اولیه آنها نتایج ناامیدکننده ای به دست آورد و تصمیم گرفت آزمایشات خود را با واکسن اصلاح شده دوباره آغاز کند. در 20 ژانویه 2021 ، شرکت آزمایشی مرحله 1/2 را ثبت کرد و در ماه ژوئن آزمایش فاز 1 را برای داوطلبان مسن ثبت کردند.
شرکت دارویی اندونزیایی Kalbe Farma در ماه آوریل متعهد شد که در صورت ایمن و م safeثر بودن 10 میلیون دوز واکسن ژنکسین را خریداری کند. در ماه جولای ، تنظیم کننده های اندونزی برای آزمایش بالینی مرحله 2/3 چراغ سبز نشان دادند.
Updated Aug. 4داروهای زیستی Gennova در هند و HDT Bio مستقر در سیاتل برای تولید واکسنی مبتنی بر RNA خود تقویت کننده همکاری کردند. این واکسن که به HGC019 معروف است ، توانست حیوانات را با ایجاد تحریک برای ایجاد آنتی بادی علیه ویروس کرونا تحریک کند و این باعث شد هند در دسامبر سال 2020 برای شروع آزمایشات مرحله 1/2 به این شرکتها مجوز بدهد. در 4 مه 2021 HDT اعلام کرد دادگاه در هند در حال انجام است.
Updated May 18GeneOne Life Science ، یک شرکت بیوتکنولوژی کره جنوبی ، یک واکسن مبتنی بر DNA ایجاد کرد که دو پروتئین ویروس کرونا را کد می کند. در دسامبر 2020 ، آنها آزمایش فاز 1/2 را با 345 شرکت کننده آغاز کردند. پس از دریافت نتایج موقت مثبت از آزمایش ، GeneOne در 8 ژوئیه 2021 اعلام کرد که مرحله 2 را آغاز می کند.
GeneOne همچنین در حال آزمایش تکنیکهای مختلف تحویل واکسن است. در 20 اکتبر، این شرکت یک آزمایش فاز 1 را ثبت کرد تا ارزیابی کند که کاندیدای آنها وقتی به بازوی بیمار تزریق می شود و به عنوان اسپری بینی تحویل داده می شود، چقدر خوب کار می کند. در این مطالعه، محققان همچنین خواهند دید که آیا یک دستگاه مکش پوست نتایج را بهبود می بخشد یا خیر. در ژانویه 2022، GeneOne آزمایش جدیدی را برای آزمایش واکسن خود به عنوان یک تقویت کننده ثبت کرد.
نام واکسن: AZD1222 (در هند با نام Covishield نیز شناخته می شود)
کارایی: بسته به مقدار مصرف ، 62 تا 90 درصد است
دوز: 2 دوز ، با فاصله 4 هفته
نوع: تزریق عضله
محل نگهداری: حداقل 6 ماه در یخچال ثابت است
سازمان بهداشت جهانی این واکسن را تایید کرده است.
واکسنی که توسط دانشگاه آکسفورد طراحی شده و توسط شرکت انگلیسی-سوئدی AstraZeneca تولید شده است به عنوان یک عنصر اصلی در تلاش برای تأمین تقاضای جهانی واکسن Covid-19 ظاهر شده است. با کارآیی 76 درصدی ، واکسن - که اکنون با نام Vaxzevria شناخته می شود - در مقادیر گسترده و با قیمت پایین تولید می شود. از آنجا که فقط به جای یخ زدگی باید در یخچال نگهداری شود ، می توان بسیار گسترده تر از واکسن های mRNA استفاده کرد. اما سفر Vaxzevria ناآرام بوده است ، و پیام های گیج کننده AstraZeneca ، نگرانی های برجسته در مورد ایمنی و مشکلات تولید را به لرزه در آورده است.
در اوایل سال 2020 ، محققان آکسفورد این واکسن را با مهندسی ژنتیک یک آدنو ویروس که به طور معمول شامپانزه ها را آلوده می کند ، تولید کردند. هنگامی که آنها واکسن را به میمون ها دادند ، دریافتند که از حیوانات در برابر بیماری محافظت می کند.
آنها که با AstraZeneca سر و کار داشتند ، آنها با یک آزمایش فاز 1/2 پیگیری کردند. تولید کنندگان واکسن در آزمایش هیچ عارضه جانبی شدیدی را مشاهده نکردند ، در حالی که مشاهده کردند واکسن باعث افزایش آنتی بادی علیه ویروس کرونا و همچنین سایر سیستم های دفاعی ایمنی می شود. AstraZeneca و آکسفورد سپس در انگلستان ، آفریقای جنوبی و جاهای دیگر مراحل آزمایشی را آغاز کردند. اما محققان این آزمایشات را به طور مستقل انجام دادند ، بنابراین ترکیب نتایج آنها در یک تصویر واضح و واضح از چگونگی عملکرد واکسن دشوار است. بدتر از همه ، آنها مقادیر مختلفی از واکسن را به افراد مختلف دادند و همچنین چهار یا دوازده هفته منتظر ماندند تا دوز دوم را تحویل دهند.
در 8 دسامبر ، AstraZeneca و آکسفورد اولین مقاله علمی را در مورد آزمایش بالینی فاز 3 واکسن ویروس کرونا منتشر کردند. این آزمایش نشان داد که این واکسن می تواند از افراد در برابر Covid-19 محافظت کند ، اما بسیاری از س questionsالات در مورد نتایج حل نشده باقی مانده است. با این وجود ، کم هزینه بودن و سهولت ذخیره سازی واکسن ، آن را برای کشورهایی که به دنبال راهی برای خروج از بیماری همه گیر هستند ، جذاب کرده است. انگلستان و آرژانتین اولین کشورهایی بودند که در 30 دسامبر مجوز واکسن را برای موارد اضطراری صادر کردند. در 3 ژانویه ، هند نسخه ای به نام Covishield را که توسط م Instituteسسه سرم هند ساخته شده است ، تصویب کرد. در 16 فوریه سازمان بهداشت جهانی واکسن را برای استفاده اضطراری در بزرگسالان 18 سال یا بالاتر توصیه کرد. برزیل در 13 مارس این واکسن را تأیید کامل کرد. در همان ماه ، کوواکس تحویل میلیون ها دوز واکسن را به کشورهای با درآمد کم و متوسط آغاز کرد. این شرکت انتظار می رود ظرفیت تولید سالانه دو میلیارد دوز باشد.
با این وجود حتی پس از اینکه میلیون ها نفر واکسن را دریافت کردند ، نگرانی های جدیدی ایجاد شد. در آفریقای جنوبی ، یک محاکمه کوچک نتوانست نشان دهد که مردم را در برابر نوع B.1.351 ، که در این کشور غالب شده است ، محافظت می کند. در 7 فوریه ، آفریقای جنوبی برنامه تولید 1 میلیون دوز واکسن AstraZeneca را متوقف کرد.
در مارس 2021 ، نگرانی دیگری پدیدار شد. تنظیم کننده های پزشکی اروپا نگران تعداد اندکی از موارد لخته شدن خون در افراد جوانی که واکسزوریا را دریافت کرده اند شدند. آژانس دارویی اروپا به این نتیجه رسید که این واکسن یک عارضه جانبی بسیار نادر دارد که در آن افراد دچار لخته شدن خون در رگهای بزرگ همراه با پلاکت کم می شوند. نهادهای نظارتی تأکید کردند که واکسن م effectiveثر است و فواید آن بیشتر از خطر ناچیز عوارض آن است. در پاسخ برخی از کشورها تصمیم گرفتند با محدود کردن واکسن به افراد مسن ، خطر را به حداقل برسانند. در ماه مه ، نروژ Vaxzevria را به طور دائم از برنامه واکسیناسیون خود حذف کرد.
با وجود حمایت جنجالی که از توسعه آن ارائه شده ، ایالات متحده هنوز مجوز واکسزوریا را نداده است. در سال 2020 ، دولت یک میلیارد دلار به AstraZeneca برای پرداخت تحقیقات ، آزمایشات بالینی و تولید کمک کرد. در آن تابستان ، این شرکت قول داد که به زودی در ماه اکتبر Vaxzevria را در ایالات متحده توزیع کند. اما نگرانی در مورد سلامت یک داوطلب در کارآزمایی بالینی ایالات متحده ، مطالعه را به مدت هفت هفته متوقف کرد. AstraZeneca نتایج دادگاه را تا مارس 2021 تحویل نداد - فقط توسط مشاوران متخصص خود برای داده های برداشت گیلاس سرزنش شد. دو روز بعد ، این شرکت اعلام کرد که بررسی کامل آزمایشات نشان داد که این واکسن 76 درصد در برابر Covid-19 و 100 درصد در برابر بیماری شدید و بستری شدن در بیمارستان اثر دارد. AstraZeneca در حال آماده سازی برنامه خود برای F.D.A. برای مجوز کامل
AstraZeneca حتی در حالی که در حال انجام آزمایشات بالینی بود ، برای تولید میلیاردها دوز Vaxzevria با تعدادی از تولیدکنندگان به توافق رسید. اما در ژانویه 2021 ، آن اعتراف کرد که از تحویل واکسن های وعده داده شده به اتحادیه اروپا بازمانده است. کمبود آن در مارس زمانی بدتر شد که هند ، با انفجار موارد جدید ، مانع از صادرات واکسن از کارخانه های خود شد. در تاریخ 26 آوریل ، کمیسیون اروپا شکایتی علیه این شرکت به دلیل نقض قرارداد ارائه داد. دادگاه در 18 ژوئن به AstraZeneca دستور داد 50 میلیون دوز اضافی Vaxzevria تحویل دهد ، كه كمتر از 90 میلیون كمیسیون اروپا بود.
در بهار ، در حالی که سایر کشورها با موج های جدید ویرانگر Covid-19 دست و پنجه نرم می کردند ، ایالات متحده تحت انتقاد شدید برای جلوگیری از مواد اولیه هند مورد نیاز هند برای تهیه کوویشیلد خود قرار گرفت. در تاریخ 25 آوریل ، دولت بایدن اعلام کرد که ممنوعیت خود را تا حدی لغو خواهد کرد. اما منتقدان همچنین به انبار میلیون ها دوز واکسن AstraZeneca اشاره دارند که ایالات متحده سال گذشته شروع به ساخت آن کرده است. اکنون که ایالات متحده به اندازه کافی واکسن از شرکت های دیگر گرفته است تا بتواند از همه شهروندان خود محافظت کند ، تماس هایی برای ارسال واکسن AstraZeneca به هند و سایر کشورهایی که نیاز مبرم دارند وجود دارد. در تاریخ 25 آوریل ، دکتر آنتونی فاوسی گفت که دولت ایالات متحده در حال بررسی ارسال واکسن ها است. اما در اواخر ماه ژوئن ، واکسن ها هنوز آزاد نشده بودند.
در همین حال ، AstraZeneca و آکسفورد تحقیقات در مورد واکسن را ادامه می دهند. در 14 فوریه ، آنها اعلام کردند که آزمایشات مربوط به کودکان 6 ساله را آغاز می کنند. در ماه ژوئن ، محققان آکسفورد گزارش دادند که سومین تقویت کننده واکسن AstraZeneca پاسخ های ایمنی شدیدی را در داوطلبان ایجاد می کند. در یک مطالعه جداگانه ، تیم دیگری از
مصوب برای استفاده در: برزیل.
استفاده متوقف شده در: دانمارک ، نروژ.
استفاده اضطراری در: الجزایر ، آنگولا ، آنتیگوا ، آرژانتین ، استرالیا ، باهاما ، بحرین ، بنگلادش ، باربادوس ، برمودا ، بوتان ، بوتسوانا ، برزیل ، برونئی ، کابو ورد جدید ، کامبوج ، کانادا ، شیلی ، کلمبیا ، کاستاریکا ، قبرس ، دومنیکن جمهوری ، اکوادور ، مصر ، السالوادور ، اتیوپی ، اتحادیه اروپا ، فیجی ، جورجیا ، غنا ، گرینلند ، گواتمالا ، هائیتی ، هندوراس ، مجارستان ، ایسلند ، هند ، اندونزی ، ایران ، عراق ، جامائیکا ، ژاپن ، کنیا ، کویت ، لبنان ، لیبی جدید ، لیختن اشتاین ، مالزی ، مالدیو ، مکزیک ، مولداوی ، مغولستان ، مراکش ، نامیبیا ، نپال ، نیجریه ، مقدونیه شمالی ، نروژ ، پاکستان ، پاناما ، پاپوآ گینه نو ، پرو ، فیلیپین ، رواندا ، عربستان سعودی ، صربستان ، سیشل ، سیرا لئون ، جزایر سلیمان ، آفریقای جنوبی ، کره جنوبی ، سریلانکا ، سنت وینسنت و گرنادین های جدید ، سنت کیتس و نویس ، سودان ، تایوان ، تایلند ، تیمور لست ، اوگاندا ، اوکراین ، انگلستان ، وانواتو NEW ، ویتنام ، زامبیا . اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی. تایید شده توسط گروه تنظیم مقررات آفریقا. برای استفاده اضطراری توسط سیستم تنظیم مقررات کارائیب توصیه می شود.
نام واکسن: CoVLP
کارایی: ناشناخته
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
محل نگهداری: در یخچال ثابت است
Medicago مستقر در کانادا ، بخشی از بودجه آن توسط شرکت تولید کننده سیگار فیلیپ موریس تأمین می شود ، واکسن ها را در گیاهی به نام Nicotiana benthamiana ، گونه وحشی مرتبط با تنباکو ، پرورش می دهد. آنها ژنهای ویروسی را به داخل برگها منتقل می کنند و سپس سلولهای گیاه پوسته های پروتئینی ایجاد می کنند که از ویروس ها تقلید می کند.
در ماه جولای ، مدیکاگو آزمایشات فاز 1 را بر روی واکسن Covid-19 گیاهی در ترکیب با مواد کمکی برای تقویت پاسخ سیستم ایمنی بدن به پروتئین های ویروسی آغاز کرد. در آن مطالعه ، آنها دریافتند که یک ماده کمکی ساخته شده توسط GSK باعث تولید نویدبخش آنتی بادی در داوطلبان می شود. در 23 اکتبر ، این شرکت اعلام کرد که با دولت کانادا برای تهیه 76 میلیون دوز به توافق رسیده است.
در آوریل 2021، دولت کانادا یک بازنگری متوالی از واکسن این شرکت را اعلام کرد. پس از رونمایی از نتایج فاز 3، Medicago آنها را برای مجوز در 16 دسامبر به مقامات بهداشتی کانادا ارسال کرد. این شرکت همچنین گفته است که قصد دارد در مارس 2022 در ژاپن مجوز دریافت کند.
Clover Biopharmaceuticals یک واکسن حاوی پروتئین سنبله از ویروس های کرونا تولید کرد. برای تحریک بیشتر سیستم ایمنی ، این شرکت به اصطلاح مواد کمکی ساخت داروخانه انگلیسی GSK و شرکت آمریکایی Dynavax را آزمایش می کند. سرمایه گذاری های ائتلاف برای آمادگی همه گیر از توسعه تولید حمایت می کند که می تواند به تولید یک میلیارد دوز در سال منجر شود. فرمول شبدر به خصوص با دوام است واکسن می تواند به مدت یک ماه در دمای اتاق بماند و زنده بماند.
شبدر در ژوئن 2020 آزمایش فاز 1 را آغاز کرد و در ماه دسامبر این شرکت اعلام کرد که این واکسن سطح بالایی از آنتی بادی ها را تحریک می کند. این یک آزمایش فاز 2/3 را با کمکی GSK ثبت کرد ، اما در فوریه 2021 این شرکت اعلام کرد که مطالعه را لغو می کند. درعوض ، با آزمایشی با کمکی Dynavax به جلو حرکت کرده است.
در 30 ژوئن 2021 ، شبدر توافق نامه ای را برای ارائه 400 میلیون دوز به COVAX ، ابتکار عمل برای واکسن زدن به کشورهای با درآمد کم و متوسط اعلام کرد. این شرکت انتظار دارد نتایج آزمایشی فاز 2/3 خود را در اواسط سال 2021 بدست آورد.
در جولای 2021 ، Clover آزمایش مرحله دوم واکسن را که برای نوع بتا طراحی شده بود ، ثبت کرد.
CEPI در 18 نوامبر متعهد شد 36.9 میلیون دلار اضافی برای توسعه این واکسن اختصاص دهد.
Clover فاز 1 آزمایشی را در ژوئن 2020 راه اندازی کرد و در دسامبر این شرکت اعلام کرد که واکسن باعث ایجاد سطح بالایی از آنتی بادی ها می شود. این شرکت آزمایشی فاز 2/3 را با کمک GSK ثبت کرد، اما در فوریه 2021 شرکت اعلام کرد که این مطالعه را لغو می کند. در عوض، با آزمایشی با کمک Dynavax پیش رفت. در 22 سپتامبر، Clover اعلام کرد که کارآزمایی نشان داد که واکسن آنها 79 درصد در برابر بیماری از نوع دلتا و 100 درصد در برابر بستری شدن در بیمارستان کارایی دارد. نتایج در ژانویه 2022 در Lancet منتشر شد. ماه بعد، Clover اعلام کرد که در سال 2022 قصد دارد از سازمان بهداشت جهانی، آژانس دارویی اروپا و سایر نهادهای نظارتی برای استفاده از واکسن آنها به عنوان یک تقویت کننده جهانی مجوز بگیرد. این شرکت گزارش داد که تقویت کننده آن سه برابر بیشتر از تقویت کننده AstraZeneca آنتی بادی تولید می کند.
Updated Feb. 15در تاریخ 18 آگوست ، رئیس اپیدمیولوژی وزارت بهداشت عمومی کوبا از اولین آزمایش آزمایش واکسن Covid-19 در این کشور خبر داد. موسسه واکسن Finlay در هاوانا آزمایش واکسنی به نام Soberana 1. را آغاز کرد. این ماده حاوی بخشی از پروتئین سنبله به نام RBD به همراه دو ماده اضافی است: پروتئین های باکتری و هیدروکسید آلومینیوم. این مواد ، که به عنوان کمکی شناخته می شوند ، پاسخ سیستم ایمنی بدن به ویروس کرونا را افزایش می دهند.
در 26 جولای، رسانه های کوبا گزارش دادند که Soberana 1 وارد فاز 2 آزمایشی شده است.
در ماه نوامبر، مقامات بهداشتی کوبا آزمایش بالینی را برای استفاده از Soberana 1 به عنوان دوز تقویت کننده تایید کردند. نتایج حاصل از آزمایش فاز 1 نشان می دهد که Soberana 1 می تواند به طور ایمن ایمنی ایجاد کند، و در صورت ترکیب با Abdala، می تواند با نوع Omicron مبارزه کند.


در اوایل سال 2020، سانوفی واکسن کووید-19 را بر اساس پروتئینهای ویروسی که با ویروسهای مهندسی شده تولید میکردند تولید کرد که در داخل سلولهای حشرات رشد میکنند. GSK این پروتئین ها را با ادجوانت هایی که سیستم ایمنی را تحریک می کنند تکمیل کرد. این واکسن که Vidprevtyn نام دارد بر اساس همان طرحی است که Sanofi برای ساخت Flublok، واکسن تایید شده برای آنفولانزا، استفاده کرد. این شرکتها آزمایش بالینی فاز 1/2 را در سپتامبر 2020 راهاندازی کردند.
انتظار می رفت که Vidprevtyn نقش مهمی در مقابله با همه گیری ایفا کند. در ایالات متحده، عملیات Warp Speed آن را به عنوان یکی از شش واکسن برای ایمن سازی در مقادیر زیاد انتخاب کرد و به توافقی 2.1 میلیارد دلاری برای 100 میلیون دوز دست یافت. در 18 سپتامبر سانوفی قرارداد دیگری با اتحادیه اروپا برای 300 میلیون دوز برای مقدار نامشخصی منعقد کرد و بعداً با کانادا برای 72 میلیون دوز به توافق رسید. علاوه بر این، سانوفی موافقت کرد که 200 میلیون دوز برای COVAX، یک همکاری بینالمللی برای تحویل عادلانه واکسن در سراسر جهان، ارائه کند. این شرکت انتظار داشت در ماه دسامبر به فاز 3 آزمایشی منتقل شود و احتمالاً تا بهار 2021 به دنبال مجوز استفاده اضطراری برای Vidprevtyn در ایالات متحده باشد. سانوفی اعلام کرد که قصد دارد تا یک میلیارد دوز در سال 2021 ایجاد کند.
اما در 11 دسامبر 2020، Sanofi و GSK اعلام کردند که Vidprevtyn ناامیدکننده است. در حالی که سطوح امیدوارکننده ای از آنتی بادی ها را در افراد زیر 50 سال ارائه می کرد، افراد مسن تر به آن شدتی که انتظار داشتند پاسخ ندادند. شرکت آزمایشی را متوقف کرد. در ژانویه سانوفی تصمیم گرفت به فایزر و BioNTech کمک کند تا 100 میلیون دوز از واکسن خود را تولید کنند و آنها به توافقی مشابه با جانسون و جانسون در ماه فوریه دست یافتند.
در همین حال، سانوفی فرمول قوی تری از Vidprevtyn را توسعه داد. در 22 فوریه، شرکت فاز 2 آزمایشی جدیدی را راه اندازی کرد که نشان داد نسخه جدید پاسخ های ایمنی قوی ایجاد می کند. آنها شروع به ثبت نام شرکت کنندگان برای فاز 3 آزمایشی خود در 27 مه کردند. در 20 ژوئیه 2021، آژانس دارویی اروپا یک بررسی چرخشی از Vidprevtyn را قبل از درخواست آنها برای مجوز آغاز کرد. سانوفی در گزارشی از درآمد در 28 اکتبر گفت که انتظار داشت نتایج آزمایشی فاز 3 جدید خود را تا پایان سال 2021 نشان دهد، اما در 15 دسامبر، این شرکت اعلام کرد که این آزمایش تا اوایل سال 2022 ادامه خواهد داشت زیرا تعداد بسیار کمی از شرکت کنندگان به بیماری مبتلا شده اند. کووید 19. با این حال، نتایج یک آزمایش تقویت کننده امیدوارکننده بود. داوطلبان واکسینه شده که واکسن شرکت را به عنوان یک تقویت کننده دریافت کردند، شاهد افزایش زیادی در آنتی بادی های ضد ویروس کرونا بودند.
Updated Dec. 16SpyBiotech ، شرکتی که از دانشگاه آکسفورد جدا شد ، واکسنی را از مخلوط پروتئین ها تولید کرد. برخی از پروتئین ها ، از ویروس های هپاتیت B ، پوسته های توخالی را تشکیل می دهند. محققان این پوسته ها را با بخشی از پروتئین سنبله کروناویروس تزئین کردند. ساخت واکسن نسبتاً آسان است زیرا پروتئین ها را می توان با تخمیر مخمر تولید کرد. پس از خالص شدن ، پروتئین ها خود را به صورت پوسته جمع می کنند.
واکسن تزریق شده به میمون ها سطح امیدوار کننده ای از پاسخ های ایمنی را ایجاد کرد. در سپتامبر 2020 ، SpyBiotech اعلام کرد که اولین داوطلبان در آزمایش مرحله 1/2 استرالیا واکسن Covid-19 خود را دریافت می کنند. موسسه سرم هند ، که مجوز این فناوری را از SpyBiotech صادر کرده است ، آزمایشات را اجرا می کند.
اما پرونده آزمایشی که از سپتامبر 2020 به روز نشده است، نشان می دهد که محققان تنها 9 داوطلب از 280 مورد انتظار را جذب کرده اند.
شیونوگی ، غول داروسازی ژاپنی ، آزمایش فاز 1/2 واکسن کرونا را در 16 دسامبر آغاز کرد. این شرکت آن را با همکاری موسسه ملی بیماریهای عفونی و دانشگاه کیوشو توسعه داد. این واکسن بر اساس پروتئین کروناویروس ساخته شده است که در سلول های حشرات توسط ویروس های تغییر یافته ژنتیکی تولید می شود. اما بر اساس گزارش ماه مارس از ژاپن تایمز ، شیونوگی برای جذب شرکت کنندگان کافی برای آزمایشات خود با مشکل روبرو شده است و بعید است که واکسن تا پایان سال 2021 آماده شود. با سرمایه گذاران ، شیونوگی گفت که پس از دریافت نتایج اولیه ناامیدکننده از آزمایش اولیه ، از یک مکمل جدید با واکسن خود استفاده می کند. آنها گفتند که آزمایش جدید مرحله 1/2 در ژوئیه 2021 آغاز شد.
Updated Aug. 4نام واکسن: SCB-2019
اثربخشی: 79 درصد در برابر بیماری از نوع دلتا، 100 درصد در برابر بستری شدن در بیمارستان
دوز: 2 دوز به فاصله 3 هفته
نوع: تزریق عضلانی
ذخیره سازی: در دمای 8-2 درجه سانتیگراد به مدت 6 ماه، دمای اتاق به مدت یک ماه پایدار است
Clover Biopharmaceuticals واکسنی تولید کرد که حاوی پروتئین اسپایک از ویروسهای کرونا است. برای تحریک بیشتر سیستم ایمنی، این شرکت پروتئین ها را با به اصطلاح ادجوانت های ساخته شده توسط داروساز بریتانیایی GSK و شرکت آمریکایی Dynavax ترکیب کرد. به نظر می رسد فرمول Clover بسیار بادوام باشد. واکسن می تواند به مدت یک ماه در دمای اتاق بماند و زنده بماند. سرمایه گذاری های ائتلاف برای آمادگی همه گیر از توسعه تولید حمایت می کند که می تواند منجر به تولید یک میلیارد دوز در سال شود. در 30 ژوئن 2021، Clover توافقی را برای ارائه 400 میلیون دوز به COVAX، ابتکار عمل برای تحویل واکسن به کشورهای با درآمد کم و متوسط اعلام کرد. CEPI در 18 نوامبر متعهد شد 36.9 میلیون دلار اضافی برای توسعه این واکسن اختصاص دهد.
Clover فاز 1 آزمایشی را در ژوئن 2020 راه اندازی کرد و در دسامبر این شرکت اعلام کرد که واکسن باعث ایجاد سطح بالایی از آنتی بادی ها می شود. این شرکت آزمایشی فاز 2/3 را با کمک GSK ثبت کرد، اما در فوریه 2021 شرکت اعلام کرد که این مطالعه را لغو می کند. در عوض، با آزمایشی با کمک Dynavax پیش رفت. در 22 سپتامبر، Clover اعلام کرد که کارآزمایی نشان داد که واکسن آنها 79 درصد در برابر بیماری از نوع دلتا و 100 درصد در برابر بستری شدن در بیمارستان کارایی دارد. نتایج در ژانویه 2022 در Lancet منتشر شد. ماه بعد، Clover اعلام کرد که در سال 2022 قصد دارد از سازمان بهداشت جهانی، آژانس دارویی اروپا و سایر نهادهای نظارتی برای استفاده از واکسن آنها به عنوان یک تقویت کننده جهانی مجوز بگیرد. این شرکت گزارش داد که تقویت کننده آن سه برابر بیشتر از تقویت کننده AstraZeneca آنتی بادی تولید می کند.
Updated Feb. 15مرکز چوماکوف در آکادمی علوم روسیه یک واکسن ویروس کرونا ویروس غیرفعال به نام CoviVac تولید کرد. در 14 اکتبر ، تاس گزارش داد که آزمایشات بالینی واکسن از 19 مهر در Kirov و سن پترزبورگ آغاز می شود. در 20 فوریه ، روسیه این واکسن را برای مصارف خانگی تصویب کرد ، علی رغم این واقعیت که مرکز چوماکوف بعداً شروع به کار کرد آزمایش فاز 3 در تاریخ 3 ژوئن ، مدیر مرکز چوماکوف گفت که آزمایش هنوز در جریان است و هنوز نمی توان در مورد اثر واکسن صحبت کرد.
استفاده زودهنگام در: روسیه.
Updated June 4
Vaxxinity مستقر در دالاس در حال آزمایش واکسنی است که شامل قسمتهایی از چندین پروتئین ویروسی است. (Vaxxinity در آوریل 2021 هنگامی که شرکت های COVAXX و United Neuroscience با هم ترکیب شدند ، شکل گرفت.)
در 11 سپتامبر ، COVAXX آزمایش فاز 1 را در تایوان ثبت کرد که منجر به تولید 100 درصد داوطلبان آنتی بادی بدون عوارض جانبی جدی شد. در فوریه ، COVAXX آزمایش فاز 2 را در تایوان آغاز کرد. مرحله آزمایشی مرحله 2/3 در برزیل ، هند و سایر کشورها آغاز شده است. در 25 نوامبر ، Covaxx توافقاتی را با کشورهایی از جمله برزیل ، اکوادور و پرو برای تحویل بیش از 140 میلیون دوز به مبلغ 2.8 میلیارد دلار اعلام کرد. در ماه ژانویه ، این شرکت اعلام کرد که آنها تحقیقات پیش بالینی را در مورد واکسنی که به طور خاص برای انواع جدید ویروس کرونا طراحی شده است که به طور بالقوه می تواند از واکسن های معمولی فرار کند ، آغاز کرده اند. در بیانیه مطبوعاتی 21 ژوئن ، Vaxxinity گفت که انتظار می رود واکسن را تا پایان تابستان تحویل دهد. محققان یک آزمایش فاز 1 را در 20 جولای ثبت کردند تا اثر دوز سوم واکسن آن را در افرادی که قبلاً دوبار دریافت کرده اند ارزیابی کنند.
در 11 فوریه 2022، Vaxxinity اعلام کرد که آنتی بادی های گرفته شده از داوطلبان در آزمایشات فاز 1 و 2 آنها در برابر نوع Omicron قوی است. در این اطلاعیه، این شرکت اعلام کرد که در حال برنامه ریزی آزمایشی فاز 3 برای اواخر سال 2022 است.

بهار سال گذشته ، محققان دانشگاه واشنگتن نانوذره ای تولید کردند که حاوی قطعاتی از پروتئین سنبله کروناویروس بود. آزمایش بر روی موش ها یک پاسخ ایمنی قوی نشان داد. شرکت واکسن کره جنوبی SK Bioscience مجوز واکسن را با نام GBP510 دریافت کرد. پس از همکاری با GSK ، آنها آزمایش فاز 1/2 واکسن را در ماه فوریه آغاز کردند. این دومین واکسنی است که SK Bioscience پس از شروع مطالعه بر روی واکسن دیگری بر اساس پروتئین به نام NBP2001 آزمایش می کند. SK Bioscience 210.1 میلیون دلار از ائتلاف برای نوآوری های آمادگی برای اپیدمی برای توسعه GBP510 دریافت کرده است. در 28 ژوئن ، SK Bioscience اعلام کرد که برای تأیید شروع آزمایشات فاز 3 درخواست داده است.
Updated Feb. 23
تولید کننده واکسن کره جنوبی EuBiologics آزمایش فاز 1/2 واکسن مبتنی بر پروتئین را در اواخر ژانویه آغاز کرد. این واکسن که با نام EuCorVac-19 شناخته می شود ، پروتئین سنبله را با یک ماده کمکی ترکیب می کند که سیستم ایمنی بدن را تحریک می کند. EuBiologics در 10 ژوئن 2021 اعلام کرد که مرحله 1 را با موفقیت به پایان رساند.
در 17 سپتامبر، آنها تزریق واکسن را برای داوطلبان فاز 2 به پایان رساندند و برنامههایی را برای آزمایش فاز 3 طراحی کردند که در آن آنها آن را با واکسن AstraZeneca، Vaxzevria مقایسه میکردند. اما نشریه کره ای بیومدیکال ریویو گزارش داد که آسترازنکا واکسن را تامین نخواهد کرد و این امر باعث ایجاد شک و تردید در مورد چشم انداز آزمایشی شده است. با این حال، در 28 ژانویه 2022، EuBiologics اعلام کرد که مجوز دولت کره جنوبی را برای ادامه آزمایشات فاز 3 دریافت کرده است.

شرکت VBI Vaccines مستقر در ماساچوست واکسن ویروس کرونا تولید کرد که بر پایه پوسته های پروتئینی توخالی و ویروسی ساخته شده است. این شرکت قطعاتی از پروتئین های ویروس کرونا را به پوسته ها اضافه کرد که برای پتانسیل آنها هم برای تولید آنتی بادی و هم برای آموزش سلولهای T برای حمله به سلولهای آلوده انتخاب شده است. در فوریه 2021 ، VBI با مقایسه اثرات استفاده از یک یا دو دوز ، یک آزمایش فاز 1/2 کنترل شده با دارونما را در کانادا ثبت کرد. در این واکسن که VBI-2902a نام دارد ، از فسفات آلومینیوم به عنوان کمکی استفاده می شود. در 29 ژوئن ، VBI نتایج اولیه این آزمایش را منتشر کرد ، که نشان می دهد داوطلبان سطح بالایی از آنتی بادی ها را تولید می کنند بدون هیچ عارضه جانبی جدی.
واکسن های VBI همچنین در حال آزمایش واکسن هایی هستند که پروتئین های سه ویروس کرونا را ترکیب می کنند و باعث بیماری شدید در انسان می شوند: Covid-19 ، SARS و MERS. آنها در حال بررسی این احتمال هستند که چنین واکسنی روزی بتواند در برابر ویروس های کرونا ویروس محافظت کند ، از جمله آنهایی که هنوز از میزبان حیوانات نریخته اند.
Updated Oct. 4
به عنوان بخشی از کنسرسیوم PREVENT-nCoV که توسط اتحادیه اروپا تأمین می شود ، تیمی از شرکت های بیوتکنولوژی و آزمایشگاه های تحقیقاتی واکسنی علیه Covid-19 تولید کردند. این ماده حاوی یک پروتئین ویروس کرونا است که نوکلئو کپسید نامیده می شود. این واکسن که ABNCoV2 نام دارد ، از فناوری اعضای کنسرسیوم AdaptVac و ExpreS2ion و غیره استفاده می کند. باواریای نوردیک پس از وعده نتایج پیش بالینی در پستانداران بزرگ ، اعلام کرد که آزمایش آزمایشی مرحله 2/1 واکسن را در هلند ادامه خواهد داد. اولین داوطلبان دوز واکسن را در 15 مارس دریافت کردند.
در 9 آگوست، محققان گفتند که آزمایش نشان داد ABNCoV2 سطوح بالایی از آنتی بادی ها را بدون عوارض جانبی خطرناک تولید می کند. اواخر همان ماه، باواریا نوردیک آزمایشات فاز 2 واکسن را هم به عنوان محافظت اولیه در برابر کووید-19 و هم به عنوان تقویت کننده سایر واکسن ها راه اندازی کرد. نتایج مثبت حاصل از کارآزمایی که در 5 دسامبر منتشر شد، نشان می دهد که واکسن به عنوان یک تقویت کننده موثر است. باواریای نوردیک انتظار دارد این واکسن را در سال 2022 به مرحله آزمایشی فاز 3 برساند.
در ماه ژوئن ، محققان چینی در آکادمی علوم پزشکی نظامی ، Suzhou Abogen Biosciences و Walvax Biotechnology اعلام کردند که اولین آزمایش های ایمنی کشور خود را بر روی واکسن مبتنی بر mRNA ، به نام ARCoV آغاز می کنند. گزارش شده است که مطالعات قبلی بر روی میمون ها اثرات محافظتی را نشان می داد ، و در آزمایش فاز 1 نشان داد که در افراد ایمن است. در 21 دسامبر ، شین هوا گزارش داد که چین در حال ساخت کارخانه ای برای تولید 120 میلیون دوز در سال است. گلوبال تایمز گزارش داد ، محققان آزمایش فاز 2 را برای واکسن در 8 ژانویه ثبت کردند. ARCoV می تواند در اوایل ماه مه وارد آزمایش فاز 3 در آمریکای لاتین شود.
Updated April 15

Takis Biotech و Rottapharm Biotech ، دو شرکت واکسن سازی در ایتالیا ، واکسنی به نام COVID-eVax تولید کردند. یک دستگاه خاص از یک نبض الکتریکی کوچک برای انتقال DNA از طریق پوست استفاده می کند. DNA وارد سلول هایی می شود که از دستورالعمل های ژنتیکی برای ساختن پروتئین های سنبله ای استفاده می کنند. در ماه فوریه ، تاکیس و روتافرم یک محاکمه فاز 1/2 را آغاز کردند. COVID-eVax می تواند در دمای اتاق ثابت بماند.
در ماه سپتامبر، این شرکتها بیانیهای مطبوعاتی منتشر کردند که در آن بیان شد که آزمایش فاز 1 نتایج امیدوارکنندهای را ارائه کرد. در آن زمان، نرخ واکسیناسیون ایتالیا به حدی افزایش یافته بود که شرکتها گفتند جذب داوطلبان کافی برای انتقال به مرحله آزمایشی فاز 2 دشوار است.


محققان مستقر در ژاپن در Daiichi Sankyo با همکاری دانشگاه توکیو واکسن mRNA علیه ویروس کرونا تولید کرده اند. آنها آزمایش فاز 1/2 واکسن را با نام DS-5670 در 22 مارس آغاز کردند.
Updated March 23
شرکت Akston Biosciences مستقر در ماساچوست واکسنی ساخته است که بخشی از پروتئین اسپایک ویروس کرونا به نام دامنه اتصال گیرنده را هدف قرار می دهد. محققان آکستون می گویند که تمرکز بر این بخش روشی کارآمد برای تقویت ایمنی در برابر انواع جدید است. آنها آزمایش فاز 1/2 واکسن خود، معروف به AKS-452 را در 12 آوریل آغاز کردند. پس از نتایج مثبت از آزمایش فاز 1، آکستون اعلام کرد که دوز شرکت کنندگان در آزمایش فاز 2 خود را در 5 اوت آغاز کرده است. در تاریخ نوامبر. 20، این شرکت گفت که 100 بیمار اول را در فاز 2 آزمایش دیگری در هند دوز مصرف کرده است. نتایج مثبت حاصل از کارآزمایی که در 22 دسامبر منتشر شد، نشان داد که واکسن میتواند پاسخ ایمنی قابل توجهی را بدون واکنشهای جانبی ایجاد کند. آنها قصد دارند این مطالعه را به مرحله 2/3 آزمایشی با 1500 داوطلب در سال 2022 گسترش دهند.
Updated Feb. 8
در 22 مارس 2021، شرکت ژاپنی KM Biologics مرحله 1/2 آزمایشی را از نامزد واکسن غیرفعال خود به نام KD-414 راه اندازی کرد. هفت ماه بعد، شرکت فاز 2/3 آزمایشی را برای واکسن خود در ژاپن در 22 اکتبر ثبت کرد. در دسامبر، KM Biologics آزمایش واکسن را به عنوان یک تقویت کننده آغاز کرد.
Updated Dec. 28شرکت بیوتکنولوژی ایتالیایی ReiThera یک واکسن Covid-19 به نام GRAd-COV2 تولید کرده است که بر اساس ویروس آدنو ویروس آلوده به گوریل ها ساخته شده است. آنها که با همکاری م Instituteسسه ملی بیماریهای عفونی Lazzaro Spallanzani در رم کار می کردند ، دریافتند که این ماده مقادیر زیادی آنتی بادی در موش و میمون تولید می کند. در ژوئیه سال 2020 ، آنها یک آزمایش بالینی فاز 1 را آغاز کردند. در ماه نوامبر ، آنها اعلام کردند که واکسن به خوبی تحمل شده و آنتی بادی تولید می کند و گزارشی از آزمایش را منتشر کردند.
در مارس 2021 ، محققان آزمایش واکسن فاز 2 را آغاز کردند. اما در ماه مه ، رویترز گزارش داد ، دادگاهی در ایتالیا طرح دولت برای تأمین بودجه آزمایش فاز 3 را لغو کرد و تولید واکسن را به تردید انداخت. بعداً دولت گفت آماده بودجه واکسن است.
در ماه مه، رویترز گزارش داد، دادگاهی در ایتالیا طرح دولت برای تامین مالی محاکمه فاز 3 را رد کرد. دولت بعداً اعلام کرد که آماده حمایت از آزمایش واکسن است، اما هنوز بودجه ارائه نکرده است. در نوامبر 2021، بنیاد بیل و ملیندا گیتس کمک مالی 1.4 میلیون دلاری به ReiThera برای ادامه توسعه واکسن اعطا کرد.
Updated Dec. 3
محققان Zhongyianke Biotech ، Liaoning Maokangyuan Biotech و آکادمی علوم پزشکی نظامی از سلول های تخمدان همستر چینی برای کمک به ایجاد ایمنی در انسان استفاده می کنند. آنها نوامبر گذشته یک آزمایش فاز 1 را در چین ثبت کردند. در 24 مارس ، آنها واکسن را به مرحله 2 منتقل کردند.
Updated March 25
محققان Elixirgen Therapeutics مستقر در بالتیمور یک واکسن RNA به نام EXG-5003 ساخته اند که قسمت کوچکی از پروتئین سنبله ویروس کرونا را هدف قرار می دهد. در ماه مه ، آنها آزمایش فاز 1/2 واکسن را در ژاپن آغاز کردند.
در 8 اکتبر، Elixirgen اعلام کرد که مجوز واکسن خود را به یک شرکت نامعلوم برای بازاریابی در سراسر جهان، به استثنای ژاپن، داده است.


محققان موسسه محصولات بیولوژیکی لانژو ، فناوری دارویی پکن ژونگ شنگ هنگ یی و دانشگاه ژنگ ژو واکسنی را آزمایش می کنند که در سلول های تخمدان همستر چینی رشد می کند. آنها در 3 مه آزمایش فاز 1/2 را ثبت کردند.
در ماه اکتبر آنها یک آزمایش فاز 3 را برای آزمایش واکسن خود به عنوان تقویت کننده واکسن ویروس غیرفعال ثبت کردند.


در بهار 2021 ، محققان دانشگاه واشنگتن واکسن نانوذره برای Covid-19 تهیه کردند. هر نانوذره کپی های زیادی از یک قطعه پروتئین به نام RBD را از پروتئین سنبله ویروس کرونا حمل می کند. Icosavax مستقر در سیاتل مجوز آزمایش و بازاریابی واکسن را با نام IVX-411 از دانشگاه واشنگتن خریداری کرد. در 8 ژوئن ، این شرکت اعلام کرد که آزمایش فاز 1/2 را در استرالیا آغاز کرده است. در این محاکمه ، با حمایت مالی بنیاد بیل و ملیندا گیتس ، برخی از داوطلبان واکسن را بهمراه یک ماده کمکی از Seqirus دریافت می کنند. دانشمندان همچنین در حال آزمایش پتانسیل واکسن خود به عنوان یک تقویت کننده هستند.
نتایج آزمایش در نیمه اول سال 2022 پیش بینی می شود.

در 7 فوریه ، ایران اعلام کرد که در حال شروع آزمایش بالینی واکسن دوم است که با نام Cov-Pars Razi شناخته می شود و توسط موسسه تحقیقات واکسن و سرم رازی تولید شده است. این واکسن حاوی قطعاتی از پروتئین های سنبله ای ویروس کرونا است و در سه دوز تجویز می شود: دو تزریق و یک اسپری بینی. محققان دوز مصرف کنندگان برای آزمایش فاز 2 خود را از 28 مه آغاز کردند.
در ژوئیه مقامات رازی قول دادند که می توانند حداقل یک میلیون دوز از واکسن را در ماه تولید کنند. در پایان ماه اوت، ایران فاز 3 آزمایشی را اجرا کرد. تهران تایمز در 12 اکتبر گزارش داد که دوز بینی واکسن انتقال ویروس را تا 90 درصد کاهش می دهد. و در 14 نوامبر، دانشمندان گزارش دادند که این واکسن ایمنی را تا یک سال تحریک می کند. مقامات بهداشتی ایران مجوز استفاده اضطراری برای واکسن را در 1 نوامبر اعطا کردند. خبرگزاری تسنیم، یک رسانه ایرانی، در 30 نوامبر گزارش داد که محققان یک آزمایش تقویتی را برای مقایسه واکسن علیه واکسن سینوفارم آغاز کردند. تسنیم بعدها گزارش داد که کوو پارس رازی سه برابر موثرتر از واکسن سینوفارم است.
شرکت استرالیایی Vaxine واکسنی تولید کرد که پروتئین های ویروسی را با یک ماده کمکی ترکیب می کند و باعث تحریک سیستم ایمنی بدن می شود. یک آزمایش فاز 1 در ژوئن سال 2020 آغاز شد و این شرکت نتایج امیدوار کننده ای را در آوریل 2021 اعلام کرد. در ژوئن ، 2021 ، واکسین آزمایش فاز 2 را در ایران آغاز کرد. اگر آزمایش های بالینی موفقیت آمیز باشد ، واکسن توسط شرکت ایرانی سینا تولید می شود و مجوز را در ژانویه 2022 گسترش داد تا Spikogen را به عنوان یک شات تقویتکننده اضافه کند. واکسین گفت که قصد دارد تا 50 میلیون دوز در سال تولید کند.
در اقدامی بیسابقه، واکسین کمپین سرمایهگذاری جمعی را در اکتبر 2021 آغاز کرد تا اسپیکوژن را به استرالیا بیاورد. تا پایان سال 2021، آنها بیش از 900000 دلار استرالیا جمع آوری کردند. در ماه دسامبر، دولت استرالیا به واکسین اجازه داد تا داده های بالینی را برای ارزیابی ارسال کند. اما کارشناسان واکسن این تلاش را زیر سوال بردند، زیرا این شرکت هنوز اطلاعات بالینی دقیقی را منتشر نکرده بود که ایمنی و اثربخشی Spikogen را نشان می دهد.
محققان در 4 ژانویه 2022 مرحله 3 آزمایشی را برای واکسن تقویت کننده اسپایکوگن ثبت کردند. آنها در به روز رسانی کمپین سرمایه گذاری جمعی خود در 30 ژانویه 2022 گفتند که آنها همچنین در حال آماده شدن برای شروع مطالعه کودکان در مورد این واکسن هستند. ایران. در بهروزرسانی دیگری در 9 فوریه، محققان گفتند که استخدام در بخش نوجوانان این مطالعه را به پایان رساندهاند، اما همچنان در حال جذب شرکتکنندگان برای سنین 5 تا 12 هستند.
استفاده اضطراری در: ایران.
Updated Feb. 9دانشمندان قزاقستانی در انستیتوی تحقیقات مشکلات ایمنی بیولوژیکی ، واکسن دوم علیه Covid-19 تولید کرده اند. برخلاف مورد اول که از ویروس های کرونا ویروس غیرفعال ساخته می شود ، این پروتئین از ویروس برای تقویت ایمنی استفاده می کند. آنها آزمایش فاز 1/2 واکسن را با نام QazCoVac-P در 15 ژوئن آغاز کردند.
سوابق کارآزمایی که نشان میداد این مطالعه در دسامبر 2021 به پایان میرسد، از ژوئیه 2021 بهروزرسانی نشده است.
محققان این موسسه گزارشی از آزمایش فاز 3 خود را در ژانویه 2022 منتشر کردند. آنها دریافتند که این واکسن اثربخشی 82 درصدی در برابر عفونت دارد. کارآزمایی برای تعیین اثربخشی در برابر بیماری شدید بسیار کوچک بود. این مطالعه هنوز در یک مجله علمی منتشر نشده است.
در سال 2019 ، محققان دانشگاه هنگ کنگ و دانشگاه Xiamen یک واکسن اسپری بینی برای آنفلوانزا بر اساس فرم ضعیف شده ژنتیکی ویروس آنفلوانزا ایجاد کردند. در اوایل سال 2020 ، آنها واکسن را مهندسی کردند تا بخشی از پروتئین سنبله ویروس کرونا را نیز تولید کند. در 9 سپتامبر ، آنها تصویب کردند که آزمایشات بالینی را با مشارکت داروخانه بیولوژیکی Beijing Wantai آغاز می کنند. آنها یک آزمایش فاز 1 را در 22 مارس 2021 ثبت کردند. در یک کنفرانس مطبوعاتی در 11 ژوئن ، یک محقق مرکز کنترل و پیشگیری بیماری های چین گفت که این واکسن آزمایشات فاز 2 را به پایان رسانده است و انتظار می رود آزمایش فاز 3 را در خارج از کشور آغاز کند.
محققان 5.4 میلیون دلار حمایت از CEPI، ائتلاف برای نوآوری های آمادگی اپیدمی دریافت می کنند.

محققان روسی در موسسه تحقیقات علمی سنت پترزبورگ واکسن ها و سرا در آژانس بیولوژیکی پزشکی فدرال واکسن زیر واحد پروتئینی را در برابر ویروس کرونا تولید کردند. TASS گزارش داد که آنها در 19 ژوئیه 2021 فاز 1/2 آزمایشی را روی واکسن، معروف به Convasel، راه اندازی کردند. ورونیکا اسکورتسووا، رهبر آژانس بیولوژیکی پزشکی فدرال، در 29 سپتامبر گفت، نتایج کارآزمایی بالینی نشان می دهد که واکسن بی خطر و مؤثر است. در 31 دسامبر، TASS گزارش داد که آماده سازی برای ساخت Convasel در سال 2022 در حال انجام است.
Updated Dec. 31



شورای تحقیقات علمی و فناوری ترکیه علاوه بر واکسن پروتئینی خود، واکسنی نیز ساخته است که از کروناویروس های غیرفعال استفاده می کند. در 29 آوریل 2021، آنها مرحله 1 آزمایشی را در ترکیه ثبت کردند.
Updated April 30فاز 3
نام واکسن: Comirnaty (همچنین به عنوان tozinameran یا BNT162b2 نیز شناخته می شود)
کارایی: 95٪
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
ذخیره سازی: ذخیره سازی فریزر فقط در –94 درجه فارنهایت (–70 درجه سانتیگراد)
سازمان بهداشت جهانی این واکسن را تایید کرده است.
در تاریخ 9 نوامبر ، Pfizer مستقر در نیویورک و شرکت آلمانی BioNTech با اعلام اینکه میزان اثر بخشی واکسن ویروس کرونا بیش از 90 درصد است ، بسیار فراتر از انتظار است ، تاریخ سازی کردند. این اولین باری بود که کسی چنین شواهدی را پیدا می کرد. بیش از یک ماه بعد ، در 11 دسامبر ، سازمان غذا و دارو اولین مجوز استفاده اضطراری را که ایالات متحده به واکسن ویروس کرونا داده است ، اعطا کرد. در 10 مه F.D.A. مجوز را برای کودکان 12 ساله گسترش داد.
کار بر روی واکسن در ژانویه سال 2020 آغاز شد ، زمانی که محققان BioNTech شروع به ساختن یک مولکول ژنتیکی به نام RNA پیام رسان (mRNA) کردند. آنها دستورالعمل های ژنتیکی ساخت پروتئین ویروس کرونا را ایجاد کردند ، معروف به سنبله. هنگامی که به سلول ها تزریق می شود ، واکسن باعث ایجاد پروتئین های سنبله ای می شود و سپس در بدن آزاد می شود و پاسخ سیستم ایمنی بدن را تحریک می کند. در ماه مارس ، BioNTech با همکاری Pfizer برای گسترش تحقیقات ، یک آزمایش بالینی را در ماه مه آغاز کرد. آنها به واکسن نام عمومی tozinameran و نام تجاری Comirnaty دادند
در آزمایشات فاز 1 ، محققان دریافتند که Comirnaty باعث تولید داوطلبان آنتی بادی علیه SARS-CoV-2 و همچنین سلولهای ایمنی به نام سلولهای T می شود که به ویروس پاسخ می دهند. در تاریخ 27 ژوئیه ، شرکت ها از آغاز آزمایش فاز 2/3 با حضور 30،000 داوطلب خبر دادند. در 12 سپتامبر ، Pfizer و BioNTech اعلام کردند که به دنبال گسترش دادگاه برای 44000 شرکت کننده هستند.
در طول تابستان و پاییز ، جهان توجه خود را بیشتر به محاکمه Pfizer-BioNTech معطوف کرد. در ماه سپتامبر ، دکتر آلبرت بورلا ، مدیر اجرایی Pfizer ، گفت که به محض ماه اکتبر ، آزمایش فاز 3 نتایج کافی را به دست می دهد تا نشان دهد که آیا واکسن م workedثر است یا خیر. پرزیدنت ترامپ با اشاره به وجود واکسن قبل از انتخابات ، پیشرفت آنها را تبلیغ کرد. اما در تاریخ 27 اکتبر ، دکتر بورلا اعلام کرد که داوطلبان حاضر در این آزمایش هنوز موارد کافی Covid-19 را برای تعیین کارایی واکسن ها تجربه نکرده اند. سرانجام ، در تاریخ 9 نوامبر ، Pfizer و BioNTech تجزیه و تحلیل اولیه خود را در مورد 94 مورد اول منتشر کردند.
طی یک ماه آینده ، Pfizer و BioNTech اطلاعات بیشتری در مورد موارد بیشتر منتشر کردند. در 8 دسامبر ، FDA تجزیه و تحلیل مستقل خود را از آزمایشات بالینی منتشر کرد. آنها تشخیص دادند که میزان Comirnaty 95 درصد است. در حالی که Comirnaty هیچ عارضه جانبی جدی ایجاد نکرد ، اما اغلب باعث خستگی کوتاه مدت ، تب و درد عضلانی می شود.
در تاریخ 2 دسامبر ، انگلستان مجوز اضطراری واکسن Pfizer و BioNTech را صادر کرد و در پی آن کشور های بیشتری به آن واگذار شدند. در تاریخ 31 دسامبر ، سازمان بهداشت جهانی واکسن را لیست استفاده اضطراری قرار داد ، که به سرعت مجوز آن در سراسر جهان سرعت می بخشد. در اسرائیل ، که پیشتاز واکسیناسیون دسته جمعی بود ، محققان دریافتند که این واکسن در دنیای واقعی همانطور که آزمایشات نشان داده است ، م wasثر است. مطالعه منتشر شده توسط مراکز کنترل بیماری در ماه مارس نشان داد که این واکسن بعد از دوز دوم 3/91٪ موثر است. در 7 مه ، Pfizer و BioNTech اعلام کردند که به دنبال F.D.A کامل هستند. تأیید واکسن آنها انتظار می رود روند این کار چند ماه طول بکشد.
با پیشرفت آزمایش ها ، Pfizer و BioNTech همچنین کارخانه های تولید Comirnaty را در مقادیر زیاد افزایش دادند. دولت ترامپ برای اطمینان از عرضه پیش از آن ، در ژوئیه 2020 به 100 میلیون دوز قرارداد 1.9 میلیارد دلاری به Pfizer و BioNTech اعطا کرد ، اما روزنامه نیویورک تایمز در ماه دسامبر گزارش داد که دولت این فرصت را در تابستان برای تأمین 100 میلیون دوز دیگر به دست آورد. . از آن زمان به بعد ، دولت های ترامپ و بایدن توافقاتی را برای مجموع 300 میلیون دوز تا تابستان به دست آوردند. در آوریل 2021 ، اتحادیه اروپا برای معامله 1.8 میلیارد دوز مذاکره کرد ، که باید کمبود بزرگی را که در اوایل انتشار واکسن تجربه کردند ، کاهش دهد. در کل ، BioNTech و Pfizer انتظار دارند در سال 2021 نزدیک به 3 میلیارد دوز تولید کنند.
در حالی که Comirnaty بسیار م provenثر بوده است ، در ابتدا توزیع این واکسن چالش برانگیز بود زیرا باید در دمای 94- درجه فارنهایت (70- درجه سانتیگراد) منجمد نگه داشته می شد. در 19 فوریه ، Pfizer و BioNTech اعلام کردند که می توانند واکسن را در دمای 25- تا 15- درجه سانتیگراد (-13 درجه فارنهایت تا 5 درجه فارنهایت) پایدار نگه دارند.
در ژانویه ، دانشمندان در مورد ظهور انواع سریع گسترش یافته که ممکن است قادر به فرار از آنتی بادی ها باشند ، نگران شدند. مطالعه ای که در ماه مه منتشر شد ، نشان داد كه Comirnaty در برابر برخی از انواع تا حدودی م effectiveثر است ، اما با این وجود محافظت شدیدی دارد. تحقیقات بعدی همچنین نشان داد که Pfizer از محافظت خوبی در برابر Delta ، گونه ای که برای اولین بار در هند شناسایی شد ، برخوردار است.
Comirnaty در حال حاضر در تعدادی آزمایش دیگر مورد آزمایش قرار گرفته است. در فوریه 2021 ، شرکت ها مطالعه ای را برای توسعه یک تقویت کننده خاص بتا اعلام کردند. آنها همچنین یک آزمایش به طور خاص برای زنان باردار و همچنین کودکان بین 5 تا 11 سال دارند. در 30 ژوئن ، پس از نتایج مثبت از محاکمه جوانان ، فایزر گفت که تصویب تصویب اضطراری برای استفاده در کودکان از همان اوایل سپتامبر. در ماه ژوئن ، محققان در آکسفورد نتایج اولیه را اعلام کردند که ترکیبی از واکسن AstraZeneca و به دنبال آن Comirnaty ، مقادیر زیادی آنتی بادی تولید می کند.
دکتر بورلا ، رئیس اجرایی ، گفت که افراد "احتمالاً" طی یک سال از دریافت دو دوز به یک واکسن اضافی نیاز دارند. Pfizer در ژوئن یک آزمایش برای ترکیب یک تقویت کننده با واکسن Prevnar ، برای بیماری پنوموکوک ، آغاز کرد.
مصوب برای استفاده در: بحرین ، برزیل ، نیوزیلند ، عربستان سعودی ، سوئیس.
استفاده اضطراری در: آرژانتین ، استرالیا ، بنگلادش ، برمودا ، بوتسوانا ، برونئی ، کابو ورد NEW ، کانادا ، شیلی ، کلمبیا ، کاستاریکا ، اکوادور ، اتحادیه اروپا ، گرینلند ، گواتمالا ، هنگ کنگ ، ایسلند ، عراق ، اسرائیل ، ژاپن ، اردن ، کویت ، لبنان ، لیبی NEW ، لیختن اشتاین ، مالزی ، مالدیو ، مکزیک ، مولداوی ، موناکو ، مغولستان ، نروژ ، مقدونیه شمالی ، عمان ، پاکستان ، پاناما ، پرو ، فیلیپین ، قطر ، سنت وینسنت و گرنادین های جدید ، صربستان ، سنگاپور ، سریلانکا ، آفریقای جنوبی ، کره جنوبی ، سنت مارتن ، تونس ، ترکیه ، اوکراین ، امارات متحده عربی ، انگلستان ، ایالات متحده ، اروگوئه ، ویتنام NEW. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی. برای استفاده اضطراری توسط سیستم تنظیم مقررات کارائیب توصیه می شود.
نام واکسن: mRNA-1273
کارایی: 94.5٪
دوز: 2 دوز ، با فاصله 4 هفته
نوع: تزریق عضله
ذخیره سازی: 30 روز با یخچال ، 6 ماه در –4 درجه فارنهایت (–20 درجه سانتیگراد)
سازمان بهداشت جهانی این واکسن را تایید کرده است.
در 18 دسامبر ، F.D.A. مجوز استفاده اضطراری برای واکسن ساخته شده توسط شرکت مدرنا مستقر در بوستون را داد. واکسن Moderna دومین واکسن مجاز توسط F.D.A است که یک هفته پس از واکسن ساخته شده توسط Pfizer و BioNTech وارد می شود. در تاریخ 1 ژوئن 2021 ، مدرنا اعلام کرد که به دنبال مجوز کامل برای واکسن خود است.
مانند Pfizer و BioNTech ، Moderna واکسن خود را از mRNA تهیه می کند. در سال های اخیر ، این شرکت واکسن mRNA را برای تعدادی بیماری آزمایش کرده است ، اما هنوز واکسن های آن را به بازار عرضه نکرده اند. در ژانویه گذشته ، آنها شروع به تولید واکسن برای ویروس کرونا کردند.
دولت ایالات متحده تلاشهای Moderna را با پشتیبانی تقریباً 1 میلیارد دلاری با حساب مالی ارائه كرد. آنها با همکاری موسسه ملی بهداشت دریافتند که این واکسن از میمون ها در برابر ویروس کرونا محافظت می کند. مارس گذشته ، دانشمندان اولین کسی بودند که واکسن Covid-19 را در آزمایشات انسانی قرار دادند. پس از آنکه نتایج این مطالعات امیدوار کننده بود ، آزمایش مرحله 3 روی 30،000 داوطلب از 27 جولای آغاز شد.
در 16 نوامبر ، Moderna اولین داده های مقدماتی آزمایش را اعلام کرد و به دنبال آن اطلاعات کامل در 30 نوامبر منتشر شد. محققان تخمین زدند که میزان واکسن 94.1 درصد است. گرچه مشخص نیست این اثر چقدر دوام خواهد داشت ، Moderna دریافت که بعد از سه ماه شرکت کنندگان در آزمایش همچنان از یک دفاع ایمنی قوی در برابر ویروس کرونا استفاده می کنند. در تاریخ 25 مه 2021 ، مدرنا اعلام کرد که این واکسن با اطمینان از کودکان 12 ساله محافظت قوی می کند. این شرکت در حال آزمایش واکسن در نوزادان و کودکان خردسال است.
در همین حال ، این شرکت برای تأمین واکسن تا زمان تأیید با چندین کشور وارد معاملات شد. در 11 آگوست سال گذشته ، در صورت اثبات ایمنی و موثر بودن واکسن ، دولت ایالات متحده 1.5 میلیارد دلار در ازای 100 میلیون دوز اضافی به این شرکت اعطا کرد. مذاکرات اضافی توافق را به 500 میلیون دوز افزایش داده است. کمیسیون اروپا 460 میلیون دوز را تأمین کرده است. Moderna معاملات مشابهی را با کشورهای دیگر از جمله کانادا ، ژاپن ، قطر و کره جنوبی انجام داده است. Moderna همچنین متعهد شده است 500 میلیون دوز به COVAX ، یک ابتکار جهانی واکسن ، برای تأمین واکسن به کشورهای کم درآمد بدهد. در 29 آوریل ، مدرنا اعلام کرد که 800 میلیون تا 1 میلیارد دوز در سال 2021 تولید می کند و قصد دارد 3 میلیارد دوز در سال 2022 تولید کند.
آزمایش های انجام شده بر روی واکسن Moderna نشان می دهد که این ماده محافظت شدیدی در برابر انواع غالب مانند بتا و دلتا ایجاد می کند. در ماه مارس ، Moderna آزمایش فاز 1 واکسن mRNA جدیدی را که به طور خاص برای نوع بتا ساخته شده بود ، آغاز کرد. یک نوع تقویت کننده خاص واکسن Moderna نتایج مثبتی را در انسان و موش به همراه داشته است. همچنین در حال انجام آزمایش فاز 1 واکسن جدید و پایدار در یخچال است. واکسن Moderna’s یکی از چندین واکسنی است که در مطالعه آکسفورد مورد آزمایش قرار گرفته و اندازه گیری می کند که دوزهای متناوب چگونه می توانند ایمنی بدن را تقویت کنند. N.I.H. یک آزمایش بالینی را برای ارزیابی واکسن Moderna's به عنوان یک تقویت کننده آغاز کرده است.
مصوب برای استفاده در: سوئیس.
استفاده اضطراری در: بوتسوانا ، کانادا ، اتحادیه اروپا ، گرینلند ، گواتمالا ، هندوراس ، ایسلند ، اسرائیل ، ژاپن ، کویت ، لیبی جدید ، مالدیو ، مولداوی ، مغولستان ، نروژ ، فیلیپین ، قطر ، سنت وینسنت و گرنادین های جدید ، سنگاپور ، جنوب کره ، تایوان ، تایلند ، انگلستان ، ایالات متحده ، ویتنام. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی.
نام واکسن: CVnCoV
کارایی: ناشناخته
دوز: 2 دوز ، با فاصله چهار هفته
نوع: تزریق عضله
ذخیره سازی: حداقل 3 ماه پایدار در دمای 36–46 درجه فارنهایت (2-8 درجه سانتیگراد)
مارس گذشته ، دولت ترامپ بدون موفقیت سعی در فریب CureVac داشت تا تحقیقات خود را در مورد واکسن mRNA خود از آلمان به ایالات متحده منتقل کند. این شرکت قبل از شروع آزمایشات بالینی در ماه ژوئیه ، با ادامه کار در آلمان شخم زد ، و پاسخ این واکسن را در موش و میمون مشاهده کرد. واکسن آنها از چند جنبه نویدبخش است: می تواند به جای یخچال در یخچال ثابت بماند و مطالعات اولیه نشان می دهد که در دوز پایین به خوبی کار می کند و هزینه آن را کاهش می دهد. در ماه دسامبر ، CureVac یک آزمایش فاز 3 را آغاز کرد و 36500 داوطلب را در آلمان استخدام کرد. اتحادیه اروپا در ماه فوریه یک بررسی گسترده را آغاز کرد ، در صورتی که نتایج آزمایش 3 فاز مثبت را تأیید کند ، سرعت آن را تأیید می کند.
در همین حال ، CureVac آماده تولید گسترده واکسن شد. این شرکت برای دستیابی به اتحادیه اروپا تا 400 میلیون دوز واکسن خود مذاکره کرد. آنها تولید 300 میلیون دوز در سال 2021 و حداکثر یک میلیارد دوز در سال بعد را پیش بینی کردند. از ژانویه 2021 ، CureVac با همکاری غول های دارویی Bayer ، Celonic ، GSK و Novartis همکاری های زیادی را برای حمایت از تولید واکسن آنها و تولید واکسن های جدید علیه ویروس کرونا انجام داد.
در ژوئن 2021 ، CureVac نتایج ناامیدکننده ای از دادگاه را گزارش داد. به طور کلی ، واکسن آنها فقط 48 درصد در برابر Covid-19 اثر داشت. این برای داوطلبان جوان تا حدودی بهتر است: برای افراد بین 18 تا 60 سال ، اثربخشی به 53 درصد افزایش یافت. در آن گروه ، محققان همچنین دریافتند که این واکسن 100 درصد در برابر بستری شدن در بیمارستان و مرگ محافظت می کند. بعداً محققان به دوز واکسن همراه با افزایش انواع جدید به عنوان دلایل بالقوه کم اثر بودن اشاره کردند.
علیرغم نتایج ناامیدکننده، این شرکت با تهیه یک درخواست به اتحادیه اروپا برای مجوز اضطراری برای استفاده از واکسن در افراد 60 سال و کمتر پیش رفت. اما تنظیمکنندههای اروپایی هیچ نشانهای از ادامه سرعت در بررسی خود ارائه نکردند. در نتیجه، در 12 اکتبر، CureVac اعلام کرد که CVnCoV را از فرآیند تأیید نظارتی خارج میکند.
در عوض، CureVac تلاش های خود را بر روی یک واکسن نسل بعدی کووید-19 به نام CV2CoV متمرکز کرده است که با GSK در حال توسعه است. این نسخه به روز شده، پروتئین های اسپایک بیشتری تولید می کند و در نتیجه پاسخ ایمنی قوی تری ایجاد می کند. در ماه نوامبر، محققان دانشگاه هاروارد مطالعهای را در مجله Nature منتشر کردند که نشان میداد میمونهایی که CV2CoV داده شده بودند، آنتیبادیهایی برای ویروس کرونا در سطحی قابل مقایسه با واکسن Comirnaty از Pfizer و BioNTech تولید کردند. رویترز در نوامبر گزارش داد که CureVac در حال برنامه ریزی برای شروع آزمایش فاز 1 بر روی CV2nCoV در چند ماه آینده است.
Updated Nov. 26نام واکسن: AG0302-COVID19
کارایی: ناشناخته
دوز: 2 دوز ، با فاصله 2 هفته
نوع: تزریق پوست
ذخیره سازی: بیش از یک سال در دمای اتاق
در تاریخ 30 ژوئن ، شرکت بیوتکنولوژی ژاپنی AnGes آزمایش فاز 1 را برای آزمایش واکسن مبتنی بر DNA آغاز کرد که با همکاری دانشگاه اوزاکا و تاکارا بیو ساخته شده است. این شرکت در ماه دسامبر به محاکمه فاز 2/3 منتقل شد.
در 6 آگوست 2021، محققان فاز 1/2 آزمایش جدیدی از واکسن را با دوز بالاتر ثبت کردند، پس از اینکه نتایج اولیه نشان داد که اثربخشی برنامه دوز اولیه کافی نیست.
در 25 نوامبر، AnGes بیانیهای منتشر کرد که در آن گزارشهایی مبنی بر اینکه پیشرفت در ساخت واکسن را کنار گذاشته بود، رد کرد. اگرچه توانایی نامزد برای تولید آنتی بادی ناامید کننده بوده است، اما آزمایشات ادامه خواهد یافت.
نام واکسن: ZyCoV-D
کارایی: ناشناخته
دوز: 3 دوز ، با فاصله 4 هفته
نوع: تزریق پوست
ذخیره سازی: به مدت سه ماه در دمای اتاق پایدار است
در ژوئیه سال 2020 ، سازنده واکسن هندی Zydus Cadila آزمایش واکسن مبتنی بر DNA را که توسط وصله پوستی تحویل داده شده است ، آغاز کرد. آنها آزمایشی فاز 2 را در 6 آگوست در ZyCoV-D آغاز کردند و در پایان دسامبر اعلام کردند که این آزمایش کامل است. در تاریخ 3 ژانویه سال 2021 ، دولت هند به زیدوس کادیلا اجازه داد تا با 30،000 داوطلب به دادگاه فاز 3 راه یابد. این شرکت در تاریخ 1 ژوئیه اعلام کرد که اثر واکسن 66.6٪ است و هیچ یک از داوطلبان واکسینه شده در این آزمایش بیماری شدیدی نداشته و از دنیا نرفته اند و این باعث شده است ZyCoV-D اولین واکسن مبتنی بر DNA باشد که علیه Covid-19 کار می کند. زیدوس کادیلا در بیانیه خود گفت که در حال درخواست مجوز اضطراری به دولت هند است.
Updated July 2نام واکسن: Sputnik V (معروف به Gam-Covid-Vac)
کارایی: 91.4٪
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
ذخیره سازی: ذخیره سازی فریزر. در حال توسعه یک فرمولاسیون جایگزین که می تواند در یخچال نگهداری شود.
موسسه تحقیقاتی گامالیا ، بخشی از وزارت بهداشت روسیه ، واکسنی با میزان کارایی 91.6 درصد ایجاد کرده است. سازندگان واکسن نتایج آزمایش فاز 3 خود را در تاریخ 2 فوریه در Lancet منتشر کردند.
Gamaleya این واکسن را که در ابتدا Gam-Covid-Vac نامیده می شد ، از ترکیب دو ویروس آدنو ویروس به نام های Ad5 و Ad26 تولید کرد. چندین سال به عنوان واکسن آزمایش شده است. با ترکیب آنها ، محققان روسی امیدوار بودند که از شرایطی که در آن سیستم ایمنی بدن می تواند واکسن را به عنوان یک جسم خارجی که باید از بین برود ، استفاده کند ، جلوگیری کند. محققان آزمایش های بالینی را در ماه ژوئن آغاز کردند.
در پایان تابستان ، دادگاه درگیر جنجال شد. در 11 آگوست ، رئیس جمهور ولادیمیر ولادین پوتین اعلام کرد که یک تنظیم کننده مراقبت های بهداشتی روسیه واکسن را تأیید کرده است که به Sputnik V. تغییر نام داده است. با این حال آزمایشات فاز 3 حتی آغاز نشده است. متخصصان واکسن این اقدام را خطرناک دانستند و بعداً روسیه اعلامیه را پس گرفت و گفت که تصویب "گواهی ثبت نام مشروط" است ، که به نتایج مثبت آزمایشات فاز 3 بستگی دارد. علاوه بر روسیه ، داوطلبان این محاکمه در بلاروس ، امارات متحده عربی و ونزوئلا نیز استخدام شدند. در 17 اکتبر ، یک آزمایش فاز 2/3 در هند آغاز شد.
در 4 سپتامبر ، سه هفته پس از اعلام پوتین ، محققان گامالیا نتایج آزمایش 1/2 فاز خود را منتشر کردند. آنها دریافتند که Sputnik V آنتی بادی هایی را برای ویروس کرونا ایجاد می کند و عوارض جانبی خفیفی دارد. در 11 نوامبر ، صندوق سرمایه گذاری مستقیم روسیه اولین شواهد اولیه از آزمایش فاز 3 خود را مبنی بر موثر بودن واکسن اعلام کرد. دانشمندان روسی بر اساس 20 مورد Covid-19 در میان شرکت کنندگان در آزمایش ، تخمین زدند که این واکسن 92 درصد کارایی را نشان می دهد.
در ماه دسامبر ، دادگاه در مجموع 78 پرونده به پایان رسید. جزئیات کامل این آزمایش در ماه فوریه منتشر شد ، که نشان دهنده اثربخشی بالا پس از دو دوز است. این آزمایش عوارض جانبی جدی را کشف نکرد. هیچ کس که واکسن زده است مورد جدی Covid-19 را تجربه نکرده است. هنوز ، در 8 ژوئن ، معاون وزیر بهداشت روسیه اولگ گریدنف گفت که کسانی که با اسپوتنیک V واکسینه شده اند ممکن است در آینده نیاز به تزریق واکسن متفاوت داشته باشند.
این آزمایش نشان نداد که Sputnik V به خوبی می تواند انواع جدید ویروس کرونا را مسدود کند. در تحقیقی که در ماه آوریل به صورت آنلاین ارسال شد ، محققان آنتی بادی های افرادی را که این واکسن را دریافت کرده اند بررسی کردند. آنها دریافتند که آنتی بادی های Sputnik V اغلب قادر به خنثی سازی ویروس کرونا نیستند ، و به این ترتیب سلول ها را آلوده می کند.
در اقدامی بی سابقه در زمینه واکسن ویروس کرونا ، موسسه Gamaleya در دسامبر سال 2020 با داروساز AstraZeneca ، که واکسن را بر اساس آدنو ویروس شامپانزه تولید می کند ، پیوست. این دو تیم واکسن های خود را با هم ترکیب کردند تا ببینند آیا این مخلوط می تواند اثر واکسن AstraZeneca را افزایش دهد. دادگاه در فوریه آغاز شد.
در نوامبر سال 2020 ، دولت روسیه پیشنهاد اسپوتنیک V را در داخل روسیه در یک کمپین واکسیناسیون گسترده آغاز کرد. اما نگران بودن این که واکسن به سرعت تصویب شده است ، منجر به تردید گسترده ای شد. در 22 دسامبر ، بلاروس اولین کشوری در خارج از روسیه بود که Sputnik V را ثبت کرد و از آن زمان تعداد دیگری از کشورها نیز این الگو را دنبال کردند. در اروپا ، جایی که انتشار واکسن به شدت متزلزل شد ، ناظران نظارتی Sputnik V را از 4 مارس آغاز کردند. اگر آژانس دارویی اروپا آن را تأیید کند ، بسیاری از کشورهای اروپایی ممکن است این واکسن را استفاده کنند.
در ماه آوریل ، تنظیم کننده واکسن برزیل Sputnik V را رد کرد ، بر اساس تعدادی از نگرانی ها ، از جمله احتمال اینکه ویروس های آدنو موجود در واکسن ها به درستی غیرفعال نشده باشند. پس از هفته ها درگیری پر تنش ، برزیل در ماه ژوئن چراغ سبز به Sputnk V داد ، اما با برخی شرایط - از جمله محدود کردن آن فقط به بزرگسالان سالم. نگرانی در مورد اثر بخشی واکسن نیز هند را وادار کرده است تا مجوز انجام آزمایشات فاز 3 را در این کشور رد کند.
در ژانویه 2021 ، محققان Gamaleya آزمایشی را آغاز کردند که در آن فقط دوز اول آدنو ویروس های Ad26 ، همان آدنو ویروس موجود در واکسن تک دوز جانسون و جانسون ، را به مردم دادند. آنها این نسخه یک دوز را "Sputnik Light" لقب دادند. در 12 فوریه ، مدیر مرکز Gameleya در یک مصاحبه تلویزیونی گفت که احتمالاً فقط چهار تا پنج ماه محافظت می کند. روسیه در تاریخ 6 مه اعلام کرد که اسپوتنیک لایت اثربخشی 79.4 درصدی را ارائه می دهد اما جزئیات مطالعه را منتشر نمی کند و نمی گوید که این دوام چه مدت طول می کشد. Sputnik Light در 6 ماه مه مجوز استفاده در روسیه را دریافت کرد. ماه بعد ، یک مطالعه در مورد یک فعالیت واکسیناسیون گسترده در آرژانتین نشان داد که اثربخشی آن بین 78.6 تا 83.7 درصد است.
استفاده اضطراری در: آلبانی ، الجزایر ، آنگولا ، آنتیگوا و باربودا ، آرژانتین ، ارمنستان ، آذربایجان ، بحرین ، بنگلادش ، بلاروس (از جمله Sputnik Light) ، بولیوی ، جمهوری صرب بوسنی ، کامرون ، جمهوری کنگو (از جمله Sputnik Light) ، جیبوتی ، اکوادور ، مصر ، هندوراس ، گابن ، غنا ، گواتمالا ، گینه ، گویان ، مجارستان ، هند ، ایران ، عراق ، اردن ، قزاقستان ، کنیا ، قرقیزستان ، لائوس ، لبنان ، مالدیو ، مالی ، موریس (از جمله Sputnik Light) ، مکزیک ، مولداوی ، مغولستان (شامل Sputnik Light) ، مونته نگرو ، مراکش ، میانمار ، نامیبیا ، نپال ، نیکاراگوئه (از جمله Sputnik Light) ، مقدونیه شمالی ، پاکستان ، تشکیلات خودگردان فلسطین (از جمله Sputnik Light) ، پاناما ، پاراگوئه ، فیلیپین ، روسیه (از جمله Sputnik Light) ، سان مارینو ، صربستان ، سیشل ، اسلواکی ، سریلانکا ، سنت وینسنت و گرنادین ها ، سوریه ، تونس ، ترکیه ، ترکمنستان ، امارات متحده عربی ، ازبکستان ، ونزوئلا (از جمله Sputnik Light) ، ویتنام ، زیمبابوه.
Updated Aug. 4نام واکسن: AZD1222 (در هند با نام Covishield نیز شناخته می شود)
کارایی: بسته به مقدار مصرف ، 62 تا 90 درصد است
دوز: 2 دوز ، با فاصله 4 هفته
نوع: تزریق عضله
محل نگهداری: حداقل 6 ماه در یخچال ثابت است
سازمان بهداشت جهانی این واکسن را تایید کرده است.
واکسنی که توسط دانشگاه آکسفورد طراحی شده و توسط شرکت انگلیسی-سوئدی AstraZeneca تولید شده است به عنوان یک عنصر اصلی در تلاش برای تأمین تقاضای جهانی واکسن Covid-19 ظاهر شده است. با کارآیی 76 درصدی ، واکسن - که اکنون با نام Vaxzevria شناخته می شود - در مقادیر گسترده و با قیمت پایین تولید می شود. از آنجا که فقط به جای یخ زدگی باید در یخچال نگهداری شود ، می توان بسیار گسترده تر از واکسن های mRNA استفاده کرد. اما سفر Vaxzevria ناآرام بوده است ، و پیام های گیج کننده AstraZeneca ، نگرانی های برجسته در مورد ایمنی و مشکلات تولید را به لرزه در آورده است.
در اوایل سال 2020 ، محققان آکسفورد این واکسن را با مهندسی ژنتیک یک آدنو ویروس که به طور معمول شامپانزه ها را آلوده می کند ، تولید کردند. هنگامی که آنها واکسن را به میمون ها دادند ، دریافتند که از حیوانات در برابر بیماری محافظت می کند.
آنها که با AstraZeneca سر و کار داشتند ، آنها با یک آزمایش فاز 1/2 پیگیری کردند. تولید کنندگان واکسن در آزمایش هیچ عارضه جانبی شدیدی را مشاهده نکردند ، در حالی که مشاهده کردند واکسن باعث افزایش آنتی بادی علیه ویروس کرونا و همچنین سایر سیستم های دفاعی ایمنی می شود. AstraZeneca و آکسفورد سپس در انگلستان ، آفریقای جنوبی و جاهای دیگر مراحل آزمایشی را آغاز کردند. اما محققان این آزمایشات را به طور مستقل انجام دادند ، بنابراین ترکیب نتایج آنها در یک تصویر واضح و واضح از چگونگی عملکرد واکسن دشوار است. بدتر از همه ، آنها مقادیر مختلفی از واکسن را به افراد مختلف دادند و همچنین چهار یا دوازده هفته منتظر ماندند تا دوز دوم را تحویل دهند.
در 8 دسامبر ، AstraZeneca و آکسفورد اولین مقاله علمی را در مورد آزمایش بالینی فاز 3 واکسن ویروس کرونا منتشر کردند. این آزمایش نشان داد که این واکسن می تواند از افراد در برابر Covid-19 محافظت کند ، اما بسیاری از س questionsالات در مورد نتایج حل نشده باقی مانده است. با این وجود ، کم هزینه بودن و سهولت ذخیره سازی واکسن ، آن را برای کشورهایی که به دنبال راهی برای خروج از بیماری همه گیر هستند ، جذاب کرده است. انگلستان و آرژانتین اولین کشورهایی بودند که در 30 دسامبر مجوز واکسن را برای موارد اضطراری صادر کردند. در 3 ژانویه ، هند نسخه ای به نام Covishield را که توسط م Instituteسسه سرم هند ساخته شده است ، تصویب کرد. در 16 فوریه سازمان بهداشت جهانی واکسن را برای استفاده اضطراری در بزرگسالان 18 سال یا بالاتر توصیه کرد. برزیل در 13 مارس این واکسن را تأیید کامل کرد. در همان ماه ، کوواکس تحویل میلیون ها دوز واکسن را به کشورهای با درآمد کم و متوسط آغاز کرد. این شرکت انتظار می رود ظرفیت تولید سالانه دو میلیارد دوز باشد.
با این وجود حتی پس از اینکه میلیون ها نفر واکسن را دریافت کردند ، نگرانی های جدیدی ایجاد شد. در آفریقای جنوبی ، یک محاکمه کوچک نتوانست نشان دهد که مردم را در برابر نوع B.1.351 ، که در این کشور غالب شده است ، محافظت می کند. در 7 فوریه ، آفریقای جنوبی برنامه تولید 1 میلیون دوز واکسن AstraZeneca را متوقف کرد.
در مارس 2021 ، نگرانی دیگری پدیدار شد. تنظیم کننده های پزشکی اروپا نگران تعداد اندکی از موارد لخته شدن خون در افراد جوانی که واکسزوریا را دریافت کرده اند شدند. آژانس دارویی اروپا به این نتیجه رسید که این واکسن یک عارضه جانبی بسیار نادر دارد که در آن افراد دچار لخته شدن خون در رگهای بزرگ همراه با پلاکت کم می شوند. نهادهای نظارتی تأکید کردند که واکسن م effectiveثر است و فواید آن بیشتر از خطر ناچیز عوارض آن است. در پاسخ برخی از کشورها تصمیم گرفتند با محدود کردن واکسن به افراد مسن ، خطر را به حداقل برسانند. در ماه مه ، نروژ Vaxzevria را به طور دائم از برنامه واکسیناسیون خود حذف کرد.
با وجود حمایت جنجالی که از توسعه آن ارائه شده ، ایالات متحده هنوز مجوز واکسزوریا را نداده است. در سال 2020 ، دولت یک میلیارد دلار به AstraZeneca برای پرداخت تحقیقات ، آزمایشات بالینی و تولید کمک کرد. در آن تابستان ، این شرکت قول داد که به زودی در ماه اکتبر Vaxzevria را در ایالات متحده توزیع کند. اما نگرانی در مورد سلامت یک داوطلب در کارآزمایی بالینی ایالات متحده ، مطالعه را به مدت هفت هفته متوقف کرد. AstraZeneca نتایج دادگاه را تا مارس 2021 تحویل نداد - فقط توسط مشاوران متخصص خود برای داده های برداشت گیلاس سرزنش شد. دو روز بعد ، این شرکت اعلام کرد که بررسی کامل آزمایشات نشان داد که این واکسن 76 درصد در برابر Covid-19 و 100 درصد در برابر بیماری شدید و بستری شدن در بیمارستان اثر دارد. AstraZeneca در حال آماده سازی برنامه خود برای F.D.A. برای مجوز کامل
AstraZeneca حتی در حالی که در حال انجام آزمایشات بالینی بود ، برای تولید میلیاردها دوز Vaxzevria با تعدادی از تولیدکنندگان به توافق رسید. اما در ژانویه 2021 ، آن اعتراف کرد که از تحویل واکسن های وعده داده شده به اتحادیه اروپا بازمانده است. کمبود آن در مارس زمانی بدتر شد که هند ، با انفجار موارد جدید ، مانع از صادرات واکسن از کارخانه های خود شد. در تاریخ 26 آوریل ، کمیسیون اروپا شکایتی علیه این شرکت به دلیل نقض قرارداد ارائه داد. دادگاه در 18 ژوئن به AstraZeneca دستور داد 50 میلیون دوز اضافی Vaxzevria تحویل دهد ، كه كمتر از 90 میلیون كمیسیون اروپا بود.
در بهار ، در حالی که سایر کشورها با موج های جدید ویرانگر Covid-19 دست و پنجه نرم می کردند ، ایالات متحده تحت انتقاد شدید برای جلوگیری از مواد اولیه هند مورد نیاز هند برای تهیه کوویشیلد خود قرار گرفت. در تاریخ 25 آوریل ، دولت بایدن اعلام کرد که ممنوعیت خود را تا حدی لغو خواهد کرد. اما منتقدان همچنین به انبار میلیون ها دوز واکسن AstraZeneca اشاره دارند که ایالات متحده سال گذشته شروع به ساخت آن کرده است. اکنون که ایالات متحده به اندازه کافی واکسن از شرکت های دیگر گرفته است تا بتواند از همه شهروندان خود محافظت کند ، تماس هایی برای ارسال واکسن AstraZeneca به هند و سایر کشورهایی که نیاز مبرم دارند وجود دارد. در تاریخ 25 آوریل ، دکتر آنتونی فاوسی گفت که دولت ایالات متحده در حال بررسی ارسال واکسن ها است. اما در اواخر ماه ژوئن ، واکسن ها هنوز آزاد نشده بودند.
در همین حال ، AstraZeneca و آکسفورد تحقیقات در مورد واکسن را ادامه می دهند. در 14 فوریه ، آنها اعلام کردند که آزمایشات مربوط به کودکان 6 ساله را آغاز می کنند. در ماه ژوئن ، محققان آکسفورد گزارش دادند که سومین تقویت کننده واکسن AstraZeneca پاسخ های ایمنی شدیدی را در داوطلبان ایجاد می کند. در یک مطالعه جداگانه ، تیم دیگری از
مصوب برای استفاده در: برزیل.
استفاده متوقف شده در: دانمارک ، نروژ.
استفاده اضطراری در: الجزایر ، آنگولا ، آنتیگوا ، آرژانتین ، استرالیا ، باهاما ، بحرین ، بنگلادش ، باربادوس ، برمودا ، بوتان ، بوتسوانا ، برزیل ، برونئی ، کابو ورد جدید ، کامبوج ، کانادا ، شیلی ، کلمبیا ، کاستاریکا ، قبرس ، دومنیکن جمهوری ، اکوادور ، مصر ، السالوادور ، اتیوپی ، اتحادیه اروپا ، فیجی ، جورجیا ، غنا ، گرینلند ، گواتمالا ، هائیتی ، هندوراس ، مجارستان ، ایسلند ، هند ، اندونزی ، ایران ، عراق ، جامائیکا ، ژاپن ، کنیا ، کویت ، لبنان ، لیبی جدید ، لیختن اشتاین ، مالزی ، مالدیو ، مکزیک ، مولداوی ، مغولستان ، مراکش ، نامیبیا ، نپال ، نیجریه ، مقدونیه شمالی ، نروژ ، پاکستان ، پاناما ، پاپوآ گینه نو ، پرو ، فیلیپین ، رواندا ، عربستان سعودی ، صربستان ، سیشل ، سیرا لئون ، جزایر سلیمان ، آفریقای جنوبی ، کره جنوبی ، سریلانکا ، سنت وینسنت و گرنادین های جدید ، سنت کیتس و نویس ، سودان ، تایوان ، تایلند ، تیمور لست ، اوگاندا ، اوکراین ، انگلستان ، وانواتو NEW ، ویتنام ، زامبیا . اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی. تایید شده توسط گروه تنظیم مقررات آفریقا. برای استفاده اضطراری توسط سیستم تنظیم مقررات کارائیب توصیه می شود.
نام واکسن: Convidecia (همچنین به عنوان Ad5-nCoV شناخته می شود)
کارایی: ناشناخته
دوز: تک دوز
نوع: تزریق عضله
ذخیره سازی: در یخچال
شرکت چینی CanSino Biologics Convidecia را با مشارکت موسسه زیست شناسی در آکادمی علوم پزشکی نظامی این کشور توسعه داد. واکسن تک شات بر اساس آدنوویروسی به نام Ad5 است. در ماه مه گذشته، محققان نتایج امیدوارکنندهای را از یک آزمایش ایمنی فاز 1 روی Convidecia منتشر کردند و در ژوئیه گزارش دادند که آزمایشهای فاز 2 آنها نشان داد که واکسن یک پاسخ ایمنی قوی ایجاد میکند. ارتش چین در اقدامی بیسابقه، این واکسن را در ۲۵ ژوئن به مدت یک سال بهعنوان «داروی مورد نیاز ویژه» تأیید کرد. در 28 نوامبر، مدیر اجرایی CanSino Biologics در مصاحبه ای گفت که حدود 40000 تا 50000 نفر Convidecia دریافت کرده اند.
از آگوست 2020، CanSino اجرای آزمایشی فاز 3 را در تعدادی از کشورها از جمله پاکستان، روسیه، مکزیک و شیلی آغاز کرد. در 25 فوریه 2021، چین تاییدیه واکسن CanSino را برای استفاده عمومی اعلام کرد.
نتایج کارآزمایی فاز 3 که در دسامبر 2021 در The Lancet منتشر شد، نشان داد که Convidecia در برابر کووید-19 اثربخشی 57.5 درصدی دارد. در برابر بیماری شدید، اثربخشی آن 91.7 درصد بود.
با گذشت زمان، مشخص شد که اثربخشی Convidecia در حال کاهش است و محققان شروع به آزمایش تقویت کننده ها کردند. در ژانویه 2022، محققان چینی گزارش دادند که یک تقویت کننده استنشاقی Convidecia در افرادی که در ابتدا واکسن متفاوتی دریافت کرده بودند، بی خطر بود و سطوح بسیار بالایی از آنتی بادی علیه ویروس کرونا تولید کرد.
مصوب برای استفاده در: چین.
استفاده اضطراری در: آرژانتین ، شیلی ، اکوادور جدید ، مجارستان ، مالزی ، مکزیک ، مولداوی ، پاکستان.

نام واکسن: Ad26.COV2.S
کارایی: ناشناخته
دوز: 1 دوز
نوع: تزریق عضله
ذخیره سازی: حداکثر دو سال در دمای 4- درجه فارنهایت (20- درجه سانتیگراد) منجمد می شود و تا سه ماه در 36-46 درجه فارنهایت (2-8 درجه سانتیگراد) در یخچال نگهداری می شود.
در 27 فوریه ، F.D.A. مجوز استفاده اضطراری برای واکسن Johnson & Johnson’s را صادر کرد ، و آن را به سومین واکسن ویروس کرونا در ایالات متحده تبدیل کرد. همچنین اولین بار بود که فقط با یک دوز به جای دو نوبت ، ایمن و موثر بود.
کاری که منجر به واکسن شد یک دهه پیش در مرکز پزشکی Beth Israel Deaconess در بوستون آغاز شد ، جایی که محققان روشی را برای ساخت واکسن از ویروسی به نام Adenovirus 26 یا به اختصار Ad26 ایجاد کردند. جانسون و جانسون از Ad26 برای تولید واکسن های ابولا و سایر بیماری ها با Ad26 استفاده کردند. در ژانویه گذشته ، این شرکت و محققان بت اسرائیل برای ایجاد واکسن ویروس کرونا همکاری کردند. مارس گذشته آنها 456 میلیون دلار از دولت ایالات متحده دریافت كردند تا از روند خود به سمت تولید حمایت كنند. پس از اینکه واکسن در آزمایشات روی میمون ها محافظت کرد ، جانسون و جانسون آزمایشات فاز 1/2 را در ماه جولای آغاز کردند.
براساس نتایج امیدوار کننده در این مطالعات ، جانسون و جانسون یک آزمایش فاز 3 را در ماه سپتامبر با استفاده از فقط یک دوز به جای دو مورد آغاز کردند. اگرچه جانسون و جانسون در ابتدا قصد داشتند 60،000 داوطلب را به خدمت بگیرند ، اما با افزایش پرونده ها ، دادگاه در 45،000 در ماه دسامبر پایان داد.
در تاریخ 29 ژانویه ، جانسون و جانسون اعلام کردند که آزمایش ثابت کرده است که واکسن ایمن و م effectiveثر است. در 24 فوریه ، F.D.A. تجزیه و تحلیل خود را از این آزمایش منتشر کردند و نتیجه گرفتند که این واکسن در ایالات متحده 72 درصد ، در آفریقای جنوبی 64 درصد و در آمریکای لاتین 61 درصد کارایی دارد. روز بعد ، بحرین اولین کشوری بود که واکسن را برای استفاده اضطراری مجاز اعلام کرد. دو روز بعد ، ایالات متحده نیز این کار را انجام داد.
بحرین اولین کشوری بود که واکسن را برای استفاده اضطراری در 25 فوریه مجاز کرد. دو روز بعد ، ایالات متحده این کار را دنبال کرد. آفریقای جنوبی بعد از اینکه یک آزمایش کوچک نشان نداد که این ماده در برابر نوع Beta که در سراسر کشور مسلط شده بود ، از استفاده از واکسن AstraZeneca برای کارکنان مراقبت های بهداشتی خود چشم پوشی کرد. آنها به جای آن از Johnson & Johnson استفاده کردند.
در آگوست سال 2020 ، دولت فدرال موافقت كرد كه در صورت تأييد واكسن ، 1 ميليارد دلار به جانسون و جانسون براي 100 ميليون دوز بپردازد. قرار بود بیشتر عرضه ایالات متحده توسط شرکت های راه حل Emergent مستقر در بالتیمور انجام شود. اما این شرکت برای راه اندازی و تولید پیچیده واکسن تلاش کرد. در آوریل 2021 ، F.D.A. یک گزارش تند درباره استانداردهای ملایم شرکت صادر کرد. حداقل 15 میلیون دوز واکسن جانسون و جانسون در کارخانه آلوده شده است. در نتیجه ، این شرکت پس از مجوز فقط 4 میلیون دوز به ایالات متحده تحویل داد و آنها را از کارخانه خود در هلند حمل کرد.
در 13 آوریل ، دولت ایالات متحده در هنگام بررسی گزارشات لخته شدن خون نادر ، مکث در استفاده از واکسن را توصیه کرد. ده روز بعد ، C.D.C. محققان 15 مورد از لخته های غیرمعمول را در نزدیک به 8 میلیون نفر از واکسن دریافت کردند. دولت تصمیم گرفت مکث را برداشته و به واکسن اخطار دهد که زنان جوان ممکن است کمی خطر عوارض جانبی جدی را داشته باشند. در جلسه 12 ماه مه ، C.D.C. محققان در مجموع 28 مورد لخته شدن خون را در بیش از 9 میلیون واکسیناسیون گزارش کردند. در میان زنان بین 30 تا 39 سال ، این میزان 12.4 مورد در هر میلیون دوز است. در زنان بین 40 تا 49 سال ، این میزان 9.4 مورد در هر میلیون دوز است. در میان زنان مسن و مردان در هر سنی ، کمتر از 3 مورد در هر میلیون دوز وجود دارد.
قرارداد جانسون و جانسون خواستار آن بود که 100 میلیون دوز را تا ژوئن 2021 تحویل دهد ، اما مشکلات مداوم آن در تاسیسات بالتیمور احتمال رسیدن آنها به هدف را بعید کرد. در 11 ژوئن ، نیویورک تایمز گزارش داد که F.D.A. به این شرکت گفت که 60 میلیون دوز را بیرون بیندازد. در تاریخ 2 مارس ، مرک اعلام کرد که در ساخت واکسن به جانسون و جانسون کمک خواهد کرد ، اما تولید سریع آن چند ماه طول خواهد کشید.
اتحادیه اروپا در 8 اکتبر 2020 برای 200 میلیون دوز به توافق مشابهی دست یافت. اما پس از ظهور نگرانی در مورد لخته شدن خون نادر ، گزارش هایی منتشر شد که E.U. ممکن است قرارداد خود را با شرکت تمدید نکند. در همین حال ، در تاریخ 29 مارس ، ائتلافی از کشورهای آفریقایی اعلام کرد که تا 40020 دوز واکسن جانسون و جانسون را تا سال 2022 ایمن کرده است. حمل و نقل می تواند به محض سه ماهه سوم سال 2021 آغاز شود. COVAX ، یک همکاری بین المللی برای تحویل واکسن به طور عادلانه در سراسر جهان ، 500 میلیون دوز را تأمین می کند. هدف این شرکت تولید یک میلیارد دوز در سال 2021 است.
در 16 نوامبر سال 2020 ، جانسون و جانسون اعلام کردند که آنها در حال شروع آزمایش دوم فاز 3 برای مشاهده اثرات دو دوز واکسن خود ، به جای فقط یک مورد هستند. نتایج در سه ماهه سوم سال 2021 پیش بینی می شود. در ماه فوریه ، این شرکت یک آزمایش برای زنان باردار نیز آغاز کرد و در ماه مارس اعلام کرد به زودی آزمایشات مربوط به کودکان را آغاز می کند. مدیر اجرایی جانسون و جانسون در مصاحبه ای در تاریخ 4 مارس گفت که این واکسن می تواند تا سپتامبر برای کودکان در دسترس باشد.
با ظهور نوع دلتا در تابستان 2021 ، جانسون و جانسون نتایج آزمایشاتی را منتشر کردند که نشان می داد واکسن آنها از دوام قابل توجهی در برابر آن محافظت می کند.
اما مطالعه دیگری از دانشمندان خارجی نشان داد که این واکسن فقط در برابر دلتا محافظت ضعیفی دارد. آزمایشهای اولیه نشان داد که واکسن جانسون و جانسون آنتیبادیهای خنثیکننده علیه نوع Omicron تولید نمیکند.
BOOSTERSON در 5 اکتبر، Johnson & Johnson درخواست مجوز اضطراری برای تقویت کننده کرد. طی چند هفته بعد، F.D.A. نتایج دو مطالعه را بررسی کرد که نشان میدهد دوز دوم واکسن ممکن است تقویت مؤثری برای ایمنی باشد.
در یک مطالعه، شرکت به 17 داوطلب آزمایشی شش ماه پس از واکسیناسیون اولیه واکسن تقویتی داد. در 25 آگوست، این شرکت اعلام کرد که تقویتکنندهها سطوح آنتیبادیهای ضد ویروس کرونا را 9 برابر بیشتر از اوج اولیه خود افزایش دادند. بعداً، این سطوح دوازده برابر شد.
در مطالعه دوم، جانسون و جانسون یک کارآزمایی فاز 3 را انجام دادند که در آن 32000 داوطلب یا یک دارونما یا دو دوز از واکسن را دریافت کردند که به فاصله 8 هفته از یکدیگر جدا شدند. در 21 سپتامبر، این شرکت گزارش داد که این جفت شاتها کارایی بسیار بالاتری نسبت به یک شات داشتند. در ایالات متحده، اثربخشی در برابر کووید-۱۹ خفیف تا شدید از ۷۴ درصد به ۹۴ درصد افزایش یافت. اثربخشی در برابر بیماری های شدید در سراسر جهان به 100 درصد افزایش یافت. در 20 اکتبر، F.D.A. تقویت کننده های مجاز جانسون و جانسون
عوارض جانبی در 13 آوریل، دولت ایالات متحده توقف استفاده از واکسن را در حین بررسی گزارشات مربوط به لخته شدن خون نادر توصیه کرد. ده روز بعد C.D.C. محققان 15 مورد لخته شدن غیرمعمول را در نزدیک به 8 میلیون نفری که واکسن دریافت کرده بودند گزارش کردند. دولت تصمیم گرفت که مکث را لغو کند و هشداری به واکسن اضافه کند مبنی بر اینکه زنان جوان ممکن است در معرض خطر جزئی عوارض جانبی شدید قرار گیرند. اما با ادامه افزایش موارد، کمیته مشورتی C.D.C در 16 دسامبر 2021 رای داد تا توصیه کند که سایر واکسن ها بر جانسون و جانسون ترجیح داده شوند.
استفاده متوقف شده در: دانمارک ، فنلاند جدید.
استفاده اضطراری در: بحرین ، بنگلادش ، بوتسوانا ، برزیل ، کانادا ، شیلی ، کلمبیا ، اتحادیه اروپا ، غنا ، گرینلند ، ایسلند ، کویت ، لیبی جدید ، لیختن اشتاین ، مالزی ، مالدیو ، مکزیک ، مولداوی ، نیجریه ، نروژ ، فیلیپین ، آفریقای جنوبی ، کره جنوبی ، سنت وینسنت و گرنادین های جدید ، سوئیس ، تایلند ، تونس ، انگلستان ، ایالات متحده ، زامبیا. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی. تایید شده توسط گروه تنظیم مقررات آفریقا.
نام واکسن: EpiVacCorona
کارایی: ناشناخته
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
محل نگهداری: تا دو سال در یخچال ثابت است
در تاریخ 26 آگوست ، موسسه وکتور ، یک مرکز تحقیقات بیولوژیکی روسیه ، آزمایش فاز 1/2 را برای یک واکسن ویروس کرونا که آنها EpiVacCorona می نامند ، ثبت کرد. این واکسن حاوی بخشهای کوچکی از پروتئینهای ویروسی است که به عنوان پپتید شناخته می شوند. کمتر از دو ماه بعد ، در 14 اکتبر ، ولادیمیر پوتین اعلام کرد که روسیه از نظر قانونی واکسن را تصویب کرده است ، و این دومین واکسن پس از واکسن Sputnik V موسسه Gamaleya است.
یک آزمایش فاز 3 در ماه نوامبر آغاز شد و از 15 دسامبر ، خبرگزاری اینترفاکس گزارش داد که 1438 داوطلب این واکسن را دریافت کرده اند.
در ژانویه ، روسیه یک کمپین واکسیناسیون گسترده را که شامل EpiVacCorona بود آغاز کرد. در ماه فوریه ، تاس گزارش داد که پاسخ ایمنی از EpiVacCorona "تقریباً یک سال" طول کشید. در تاریخ 3 مارس ، موسسه وکتور آزمایشات خود را در یک رجیستری بین المللی ثبت کرد ، نشان می دهد که انتظار می رود نتایج اولیه را در آگوست 2021 ارائه دهند. Tass در اوایل ماه مه گزارش داد که بیش از 90٪ از افرادی که واکسن دریافت کرده اند ، آنتی بادی تولید کرده اند.
نتایج حاصل از آزمایش EpiVacCorona's Phase 1/2 در اواخر ماه مارس در یک ژورنال مبهم روسیه منتشر شد ، اما این اطلاعات مربوط به متخصصان خارجی است که به نقایص جدی در این مطالعه اشاره کرده اند.
در تاریخ 5 ژوئیه ، Tass گزارش داد که موسسه Vector در حال ثبت واکسن با نام Aurora-CoV است.
مصوب برای استفاده در: ترکمنستان.
استفاده زودهنگام در: روسیه.
نام واکسن: NVX-CoV2373 (همچنین به عنوان Covovax یا Nuvaxovid شناخته می شود)
اثربخشی: 90.4٪
دوز: 2 دوز به فاصله 3 هفته
نوع: تزریق عضلانی
ذخیره سازی: در یخچال ثابت است
با حمایت گسترده دولت ایالات متحده، Novavax مستقر در مریلند یک واکسن مبتنی بر پروتئین بسیار مؤثر تولید کرد. اما مشکلات تولید به طور قابل توجهی عرضه آن را کند کرد. تا نوامبر 2021 بود که این شرکت شروع به دریافت مجوزهای اضطراری از جمله از هند، آفریقای جنوبی، بریتانیا، اتحادیه اروپا و سازمان بهداشت جهانی کرد. Novavax برای مجوز استفاده اضطراری در 31 ژانویه 2022 از سازمان غذا و داروی ایالات متحده درخواست کرد.
توسعه واکسن قبل از همه گیری، Novavax تعدادی واکسن برای بیماری ها با اتصال پروتئین های ویروسی به ذرات میکروسکوپی تولید کرد. در سال 2019، واکسن آنفولانزای شرکت فاز 3 آزمایشات بالینی را به پایان رساند، اما هنوز یک واکسن به بازار ارائه نکرده است.
در ماه مه 2020، این شرکت آزمایشهایی را برای واکسن کووید-19 آغاز کرد که آن را NVX-CoV2373 نامید. ائتلاف برای نوآوری های آمادگی اپیدمی 384 میلیون دلار برای حمایت از این تحقیق سرمایه گذاری کرد. در ماه جولای، دولت ایالات متحده به Novavax 1.75 میلیارد دلار دیگر برای حمایت از آزمایشات بالینی و ساخت واکسن اعطا کرد.
نتیجه کارآزمایی پس از دریافت نتایج امیدوارکننده از مطالعات اولیه روی میمونها و انسانها، Novavax فاز 2 آزمایشی را روی 2900 نفر در آفریقای جنوبی در آگوست 2020 راهاندازی کرد و ماه بعد آزمایش فاز 3 را با حداکثر 15000 داوطلب در بریتانیا راهاندازی کرد. آزمایش فاز 3 در ایالات متحده به دلیل مشکلاتی در تولید دوزهای مورد نیاز برای مطالعه به تعویق افتاد. سرانجام در 28 دسامبر 2020 راه اندازی شد.
در 11 مارس 2021، Novavax گزارش داد که کارآزمایی بریتانیایی آن میزان اثربخشی 96 درصد در برابر ویروس کرونای اصلی و اثربخشی 86 درصد در برابر نوع آلفا را تعیین کرده است. در یک مطالعه بر روی نزدیک به 30000 داوطلب در ایالات متحده در مکزیک، اثربخشی واکسن 90.4 درصد بود. نتایج یک مطالعه اطفال نشان می دهد که اثربخشی واکسن 82 درصد در برابر نوع دلتا بوده است.
مجوز علی رغم عملکرد قوی NVX-CoV2373 در آزمایشات بالینی، مسیر Novavax برای دریافت مجوز طولانی و دشوار بوده است. این شرکت با تأخیر در تولید مواجه بوده و تلاش کرده است تا آزمایشهای قابل اعتمادی را برای کیفیت واکسنهای خود ایجاد کند. در آگوست 2021، دولت ایالات متحده گفت که تا زمانی که این شرکت نگرانیهای تنظیمکنندهها در مورد کار خود را برطرف نکند، بودجه تولید بیشتر واکسن Novavax را تامین نخواهد کرد.
Politico در 19 اکتبر گزارش داد که Novavax همچنان در تلاش برای تولید دوزهای کافی برای رسیدن به اهداف خود است و باعث شد سهام شرکت 24 درصد کاهش یابد.
توزیع Novavax در سپتامبر 2020 با مؤسسه سرم هند، تولید کننده بزرگ واکسن، به توافق رسید. این کشور اکنون با کشورهای دیگر از جمله بریتانیا، کانادا، استرالیا، اسرائیل و کره جنوبی قرارداد دارد. در یک کنفرانس مطبوعاتی در 3 فوریه 2022، یکی از نمایندگان Novavax گفت که این شرکت انتظار دارد در طول سال 2022، 2 میلیارد دوز تولید کند تا به توافقات با کشورها و همچنین COVAX، کنسرسیومی که به دنبال توزیع واکسن برای همه است، عمل کند. کشورهای سراسر جهان
از آنجایی که Novavax در رسیدن به آزمایشات بالینی کند بود، این یکی از اولین شرکت هایی بود که کارایی واکسن های خود را در برابر انواعی که از اوایل سال 2021 ظاهر شدند اندازه گیری کرد. در یک کارآزمایی بالینی کوچک در آفریقای جنوبی، Novavax دریافت که نوع بتا به شدت کاهش می دهد. اثربخشی واکسن کمتر از 50 درصد است. این اثربخشی ممکن است به طور غیرمعمول پایین بوده باشد زیرا برخی از داوطلبان در مطالعه H.I.V داشتند. و بنابراین سیستم ایمنی ضعیف شده بود. Novavax تخمین زد که اثربخشی واکسن علیه بتا در افراد بدون H.I.V 60 درصد است. در 22 دسامبر، Novavax اعلام کرد که واکسن آن نیز مقداری از قدرت خود را در برابر نوع Omicron از دست داده است، اما یک تزریق تقویت کننده بخش زیادی از محافظت آن را بازیابی کرد. در یک کنفرانس مطبوعاتی در 3 فوریه 2022، نماینده ای از Novavax گفت که این شرکت در حال توسعه یک نسخه مخصوص Omicron از واکسن است.
BOOSTERSON در 21 دسامبر 2021، Novavax اعلام کرد که فاز 3 کارآزمایی بالینی خود را به یک کارآزمایی تقویت کننده گسترش می دهد. آنها به داوطلبان تزریق سوم NVX-CoV2373 را می دهند تا ایمنی و کارایی آن را مشاهده کنند. در یک کارآزمایی جداگانه، محققان بریتانیایی واکسن Novavax را در یک آزمایش "مخلوط و تطبیق" آزمایش کردند، که در آن داوطلبان برای تقویت کننده از واکسنی به واکسن دیگر تغییر میکردند. محققان دریافتند که NVX-CoV2373 آنتیبادیهای کروناویروس را به سطوح بالایی افزایش میدهد.
برای جزئیات بیشتر، نحوه عملکرد واکسن Novavax را ببینید.
تایید شده برای استفاده در: کره جنوبی جدید.
استفاده اضطراری در: استرالیا NEW، هند، اندونزی، ایرلند، نیوزلند جدید، فیلیپین، بریتانیا NEW. مجوز مشروط در اتحادیه اروپا. تایید استفاده اضطراری از سازمان بهداشت جهانی.
نام واکسن: ZF2001
کارایی: ناشناخته
دوز: 3 دوز ، با فاصله 4 هفته
نوع: تزریق عضله
شرکت چینی Anhui Zhifei Longcom و انستیتوی زیست پزشکی در آکادمی علوم پزشکی چین برای ساخت واکسن همکاری کردند. نامزد آنها از یک کمکی همراه با بخشی از پروتئین سنبله به نام حوزه اتصال گیرنده تشکیل شده است. آنها آزمایشات فاز 2 را در ماه ژوئیه آغاز کردند و پس از آن آزمایش فاز 3 با 29000 داوطلب در ماه دسامبر انجام شد. چین واکسن را برای استفاده اضطراری در 15 مارس مجاز دانست.
در 14 ژوئیه، محققان فاز 1 آزمایشی را برای این واکسن در کودکان و نوجوانان ثبت کردند. آنها در 6 نوامبر به فاز 2 منتقل شدند. این شرکت در 27 اوت اعلام کرد که واکسن آنها دارای میزان اثربخشی 82 درصد در برابر کووید-19 با هر شدتی است. اندونزی Zifivax را در 7 اکتبر مجاز کرد. محققان فاز 3 آزمایشی را در 4 نوامبر ثبت کردند تا آزمایش کنند که چگونه ترکیب Zifivax با واکسن آنفلوانزا باعث تحریک سیستم ایمنی می شود. و در 22 نوامبر، محققان مرحله 3 آزمایش دیگری را برای سنجش اثربخشی ارائه سومین دوز واکسن خود شش ماه پس از اولین دوز ثبت کردند. آنها یک کارآزمایی متفاوت را در 20 ژانویه 2022 برای ارزیابی تقویت کننده 12 ماه پس از تکمیل رژیم اولیه ثبت کردند. در اواخر همان ماه، آنها همچنین آزمایشهایی را برای واکسن به عنوان یک تقویتکننده با CoronaVac و BBIBP-CorV ثبت کردند.
استفاده اضطراری در: چین ، ازبکستان.
Updated Jan. 20نام واکسن: CoVLP
کارایی: ناشناخته
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
محل نگهداری: در یخچال ثابت است
Medicago مستقر در کانادا ، بخشی از بودجه آن توسط تولید کننده سیگار فیلیپ موریس تأمین می شود ، واکسن ها را در گیاهی به نام Nicotiana benthamiana ، گونه وحشی مربوط به تنباکو ، پرورش می دهد. آنها ژن های ویروسی را به داخل برگ ها منتقل می کنند و سپس سلول های گیاهی پوسته های پروتئینی ایجاد می کنند که از ویروس ها تقلید می کند.
در ماه جولای ، مدیکاگو آزمایشات فاز 1 را بر روی واکسن Covid-19 گیاهی در ترکیب با مواد کمکی برای تقویت پاسخ سیستم ایمنی بدن به پروتئین های ویروسی آغاز کرد. در آن مطالعه ، آنها دریافتند که یک ماده کمکی ساخته شده توسط GSK باعث تولید نویدبخش آنتی بادی در داوطلبان می شود. در 23 اکتبر ، این شرکت اعلام کرد که با دولت کانادا برای تهیه 76 میلیون دوز به توافق رسیده است.
در آوریل 2021، دولت کانادا یک بازنگری متوالی از واکسن این شرکت را اعلام کرد. پس از رونمایی از نتایج فاز 3، Medicago آنها را برای مجوز در 16 دسامبر به مقامات بهداشتی کانادا ارسال کرد. این شرکت همچنین گفته است که قصد دارد در مارس 2022 در ژاپن مجوز دریافت کند.
Clover Biopharmaceuticals یک واکسن حاوی پروتئین سنبله از ویروس های کرونا تولید کرد. برای تحریک بیشتر سیستم ایمنی ، این شرکت به اصطلاح مواد کمکی ساخت داروخانه انگلیسی GSK و شرکت آمریکایی Dynavax را آزمایش می کند. سرمایه گذاری های ائتلاف برای آمادگی همه گیر از توسعه تولید حمایت می کند که می تواند به تولید یک میلیارد دوز در سال منجر شود. فرمول شبدر به خصوص با دوام است واکسن می تواند به مدت یک ماه در دمای اتاق بماند و زنده بماند.
شبدر در ژوئن 2020 آزمایش فاز 1 را آغاز کرد و در ماه دسامبر این شرکت اعلام کرد که این واکسن سطح بالایی از آنتی بادی ها را تحریک می کند. این یک آزمایش فاز 2/3 را با کمکی GSK ثبت کرد ، اما در فوریه 2021 این شرکت اعلام کرد که مطالعه را لغو می کند. درعوض ، با آزمایشی با کمکی Dynavax به جلو حرکت کرده است.
در 30 ژوئن 2021 ، شبدر توافق نامه ای را برای ارائه 400 میلیون دوز به COVAX ، ابتکار عمل برای واکسن زدن به کشورهای با درآمد کم و متوسط اعلام کرد. این شرکت انتظار دارد نتایج آزمایشی فاز 2/3 خود را در اواسط سال 2021 بدست آورد.
در جولای 2021 ، Clover آزمایش مرحله دوم واکسن را که برای نوع بتا طراحی شده بود ، ثبت کرد.
Sinopharm همراه با واکسن انستیتوی پکن خود یک واکسن ویروس غیرفعال را که توسط م Instituteسسه محصولات بیولوژیکی ووهان ساخته شده آزمایش کرد. آزمایش فاز 1/2 نشان داد که این واکسن در افراد داوطلب آنتی بادی تولید می کند ، برخی از آنها تب و سایر عوارض جانبی را تجربه می کنند. Sinopharm گفت: اثر واکسن 72.51 درصد است. نسخه واکسن ووهان در چندین مرحله در حال آزمایش فاز 3 است. در ماه دسامبر ، پرو آزمایش سینوفرم خود را برای بررسی مشکلات عصبی که یک داوطلب تجربه کرده بود ، به طور مختصر متوقف کرد ، اما تشخیص داد که هیچ ارتباطی با واکسن ها ندارد. در تاریخ 25 فوریه ، چین تصویب واکسن ووهان برای استفاده عمومی را اعلام کرد. اثر تعیین شده از آزمایشات فاز 3 هنوز منتشر نشده است.
مصوب برای استفاده در: چین.
استفاده محدود در: امارات متحده عربی..
نام واکسن: CoronaVac (قبلا PiCoVacc)
اثربخشی: 50.65 درصد در آزمایش برزیل، 83.5 درصد در کارآزمایی ترکیه
دوز: 2 دوز با فاصله 2 هفته
نوع: تزریق عضلانی
ذخیره سازی: در یخچال
Coronavac که توسط شرکت خصوصی چینی Sinovac ساخته شده است، به عنوان یکی از واکسن های پیشرو در چین ظاهر شده است، با یک میلیارد دوز در سراسر جهان از اوت 2021 توزیع شده است. اما نگرانی هایی در مورد مدت زمان حفاظت از آن ایجاد شده است.
توسعه واکسن در اوایل سال 2020، Sinovac واکسن Coronavac را بر اساس کروناویروسهای غیرفعال تولید کرد. آنها در آزمایشات روی میمون ها دریافتند که واکسن به میزان قابل توجهی میزان ویروس کرونا را که پس از عفونت در حیوانات رشد می کند کاهش می دهد و آنها سریعتر از میمون های واکسینه نشده بهبود می یابند.
نتیجه کارآزمایی پس از ساخت واکسن خود در بهار گذشته، Sinovac مرحله 1/2 آزمایشی را روی 743 داوطلب انجام داد که هیچ عارضه جانبی شدیدی نشان نداد. Sinovac جزئیات کارآزمایی را در ماه نوامبر در یک مجله پزشکی منتشر کرد که تولید نسبتاً کمی از آنتی بادی ها را نشان می داد. در ماه ژوئیه، Sinovac فاز 3 آزمایشی را در برزیل و به دنبال آن سایرین در اندونزی و ترکیه راه اندازی کرد.
آزمایشات در برزیل و ترکیه نشان داد که می تواند در برابر کووید-19 محافظت کند، اما آنها نتایج بسیار متفاوتی را ارائه کردند - تا حدی به این دلیل که کارآزمایی ها را متفاوت طراحی کردند. در برزیل، اثربخشی در برابر کووید-19 با یا بدون علائم 50 درصد بود. در برابر بیماری شدید، اثربخشی آن 100 درصد بود. کارآزمایی ترکیه نشان داد که اثربخشی در برابر کووید-19 با حداقل یک علامت 83.5 درصد بود.
پس از اینکه CoronaVac در کشورهای دیگر مورد استفاده قرار گرفت، برخی از آنها مطالعاتی را برای سنجش اثربخشی آن انجام دادند. در شیلی، محققان 10.5 میلیون نفر را که واکسینه شده بودند بررسی کردند و تخمین زدند که این واکسن 67 درصد در برابر علائم کووید-19 اثربخشی دارد و 85 درصد در برابر بستری شدن در بیمارستان محافظت می کند.
Sinovac مرحله 2 آزمایش واکسن را در کودکان و نوجوانان در 13 مه ثبت کرد. آنها در 5 اوت به فاز 3 و سپس در 20 ژانویه 2022 به فاز 4 منتقل شدند. نتایج اولیه آزمایش، در 5 نوامبر منتشر شد. ، نشان می دهد که واکسن هیچ عارضه جانبی جدی نشان نداده است و در تحریک سیستم ایمنی موثر است.
مجوز چین از تابستان 2020، مدتها قبل از مجوز رسمی، اعطای CoronaVac به برخی از شهروندان خود را آغاز کرد. در ماه اکتبر، مقامات شهر جیاکسینگ در شرق چین اعلام کردند که CoronaVac را به افرادی که مشاغل نسبتاً پرخطر دارند، از جمله کارکنان پزشکی، بازرسان بندر و پرسنل خدمات عمومی، می دهند.
اندونزی مجوز اضطراری واکسن را در 11 ژانویه صادر کرد و دو روز بعد رئیس جمهور اندونزی تزریقی از CoronaVac را در تلویزیون زنده دریافت کرد. ترکیه در 13 ژانویه مجوز واکسن را صادر کرد و رئیس جمهور آن روز بعد واکسینه شد. برزیل در 17 ژانویه مجوز CoronaVac را صادر کرد.
در 6 فوریه 2021، Sinovac اعلام کرد که چین تأیید مشروط CoronaVac را داده است. چین مجوز خود را برای کودکان و نوجوانان در 4 ژوئن گسترش داد. هر دو مجوز قبل از انتشار داده های فاز 3 ارائه شده بودند. پس از بررسی نتایج کارآزمایی بالینی، سازمان بهداشت جهانی مجوز اضطراری واکسن را در 1 ژوئن 2021 صادر کرد.
در 4 ماه مه، آژانس دارویی اروپا اعلام کرد که در حال راه اندازی یک بازنگری متوالی از CoronaVac است که در صورت تصمیم شرکت برای درخواست مجوز، مجوز بازاریابی Sinovac را تسریع می بخشد.
DISTRIBUTIONSinovac با حداقل 11 کشور و منطقه برای تامین SinoVac قرارداد بسته است. Sinovac در تاریخ 12 ژوئیه به توافقی مبنی بر عرضه حداکثر 550 میلیون دوز به COVAX، ابتکار عمل برای توزیع واکسن در کشورهای با درآمد کم و متوسط دست یافت. در 31 دسامبر 2021، این شرکت اعلام کرد که فروش خود به 11 میلیارد دلار در شش ماه اول سال افزایش یافته است.
تقویتکنندهها سازمان جهانی بهداشت توصیه میکند که افراد بالای 60 سالی که سینوواک دریافت میکنند واکسن تقویتکننده با همان واکسن یا واکسن دیگر تزریق کنند.
برخی از اولین شواهد مبنی بر اینکه ممکن است تقویت کننده ها مورد نیاز باشد در بهار 2021 بود، زمانی که بیش از 350 پزشک و کارمند مراقبت های بهداشتی در اندونزی علیرغم واکسینه شدن کامل با سینوواک به کووید-19 مبتلا شدند. این گزارشهای نگرانکننده نگرانیهایی را برانگیخت که حفاظت از CoronaVac در حال کاهش است. سازمان بهداشت جهانی در مجوز ژوئن 2021 خود برای واکسن اشاره کرد که آنها علائم احتمالی کاهش ایمنی را در سه ماه اول کارآزمایی بالینی در برزیل مشاهده کردند. مطالعه ای که در 25 جولای منتشر شد نشان داد که شش ماه پس از دریافت دو دوز، بزرگسالان سالم افت زیادی در سطح آنتی بادی را تجربه کردند. همان مطالعه نشان داد که تقویت کننده CoronaVac می تواند سطوح بالای آنتی بادی را بازگرداند.
در ماه اوت، محققان شیلیایی مرحله 2 آزمایشی را برای ارزیابی اثربخشی تزریق واکسن متفاوت به عنوان تقویت کننده برای افرادی که واکسن Sinovac دریافت کرده بودند، ثبت کردند. CoronaVac همچنین بخشی از آزمایش واکسن ترکیبی با واکسن Inovio است. نتایج یک مطالعه چینی که در 7 سپتامبر منتشر شد، نشان میدهد که تزریق واکسن تقویتکننده CanSino پس از واکسن Sinovac، پاسخ آنتیبادی قویتری نسبت به تزریق سوم واکسن Sinovac ایجاد میکند. یک مطالعه برزیلی، که نتایج آن در ژانویه 2022 منتشر شد، نشان میدهد که دادن دوز از واکسنهای دیگر به جای دوز سوم Sinovac ایمنی بهتری در برابر جدیدترین واکسنها ایجاد میکند.
برای جزئیات بیشتر، به نحوه عملکرد واکسن Sinovac مراجعه کنید.
تایید شده برای استفاده در: چین.
استفاده متوقف شده در: مالزی.
استفاده اضطراری در: آلبانی، الجزایر، ارمنستان، آذربایجان، بنگلادش، بنین، بولیوی، بوتسوانا، برزیل، کامبوج، شیلی، کلمبیا، جیبوتی، دومینیکا، جمهوری دومینیکن، اکوادور، السالوادور، مصر، گابن، گرجستان، گینه، گویان، هنگ کنگ، اندونزی، قزاقستان، لائوس، مالاوی، مالزی، مکزیک، مولداوی، مراکش، میانمار، نپال، عمان، پاکستان، پاناما، پاراگوئه، فیلیپین، سنت وینسنت و گرنادین، سن مارینو، عربستان سعودی، صربستان NEW، سیشل NEW، اسلواکی NEW، آفریقای جنوبی، سریلانکا، سوریه NEW، تاجیکستان، تانزانیا، تایلند، تیمور-لسته، توگو، ترینیداد و توباگو، تونس، ترکیه، ترکمنستان NEW، اوکراین، اروگوئه، ازبکستان NEW، ونزوئلا، ویتنام NEW، زیمبابوه . تایید استفاده اضطراری از سازمان بهداشت جهانی.
نام واکسن: BBIBP-CorV
اثربخشی: 78.1٪
دوز: 2 دوز به فاصله 3 هفته
نوع: تزریق عضلانی
BBIBP-CorV، واکسنی که توسط موسسه محصولات بیولوژیکی پکن و شرکت دولتی چینی سینوفارم ساخته شده است، به عنوان واکسن پیشرو کووید-19 در چین در داخل و خارج از کشور ظاهر شده است. در سپتامبر 2021، رئیس این شرکت در مصاحبه ای با چاینا دیلی گفت که سینوفارم به ظرفیت تولید سالانه 7 میلیارد دوز رسیده است.
توسعه واکسن محققان در موسسه BBIP-CorV را با رشد ویروسهای کرونای زنده در سلولها و سپس پاشیدن آنها با مواد شیمیایی برای غیرفعال کردن آنها تولید کردند. این ویروس های غیرفعال که به بدن تزریق می شوند، نمی توانند سلول ها را آلوده کنند، اما می توانند توجه سیستم ایمنی را به خود جلب کنند. در ژوئن 2020، محققان گزارش دادند که این واکسن نتایج امیدوارکنندهای را در میمونها ایجاد کرد.
نتیجه آزمایش فاز 1/2 کارآزمایی نشان داد که واکسن هیچ عارضه جانبی جدی ایجاد نمیکند و افراد را قادر میسازد تا آنتیبادیهایی علیه ویروس کرونا بسازند. مرحله 3 آزمایشی در امارات متحده عربی در ژوئیه 2020 و در مراکش و پرو در ماه بعد آغاز شد.
در 30 دسامبر، سینوفارم اعلام کرد که این واکسن دارای اثربخشی 79.34 درصد است که باعث شد دولت چین آن را تأیید کند. در 7 می 2021، سازمان بهداشت جهانی تخمین اثربخشی مشابه 78.1 درصد را ارائه کرد و مجوز استفاده اضطراری واکسن را صادر کرد. در 3 اوت، بلومبرگ گزارش داد که نتایج یک مطالعه مجارستانی نشان داد که واکسن نتوانست آنتی بادی کافی در بیش از یک چهارم افراد مسن تولید کند. رویترز در 13 اوت گزارش داد که نتایج یک کارآزمایی در پرو نشان می دهد که واکسن 50.4 درصد در پیشگیری از عفونت در میان کارکنان مراقبت های بهداشتی موثر بوده است.
مجوز در تابستان 2020، مدتها قبل از تکمیل فاز 3 آزمایشی، دولت چین تأیید اضطراری Sinopharm را در تابستان 0f 2020 صادر کرد. مقامات دولتی، کارکنان مراقبت های بهداشتی و سایر گروه های منتخب دریافت BBIBP-CorV را آغاز کردند. در 14 سپتامبر، امارات متحده عربی. مجوز اضطراری برای استفاده از واکسن سینوفارم برای کارکنان مراقبت های بهداشتی صادر کرد و به زودی مقامات دولتی و سایرین نیز آن را دریافت کردند. کمتر از دو ماه بعد، در 9 دسامبر، امارات متحده عربی. به BBIBP-CorV تایید کامل داد. از آن زمان تعدادی از کشورهای خاور نزدیک به آن مجوز داده اند. در 29 ژانویه، مجارستان مجوز BBIBp-CorV را صادر کرد و این کشور را به اولین کشور اروپایی تبدیل کرد که از واکسن چینی استفاده می کند.
این واکسن برای استفاده اضطراری در کودکان و نوجوانان در چین در 20 جولای تایید شد. U.A.E. این واکسن را برای استفاده در افراد سه سال به بالا در 2 اوت تایید کرد.
انواع در فوریه 2021، با افزایش نگرانی ها در مورد جهش های جدید در ویروس کرونا، محققان چینی BBIBP-CorV را در برابر گونه ای به نام Beta.1.351 که برای اولین بار در آفریقای جنوبی یافت شد، آزمایش کردند. آنها گزارش دادند که پاسخ آنتی بادی ایجاد شده توسط واکسن فقط نسبت به بتا ضعیف تر بود. B.1.351. این مطالعه هنوز در یک مجله پزشکی منتشر نشده است. مطالعه دیگری از سریلانکا که در ماه ژوئیه منتشر شد، نشان داد که BBIBP-CorV پاسخ های آنتی بادی به نوع دلتا تولید می کند که به اندازه آنتی بادی های تولید شده توسط عفونت طبیعی قوی است.
تقویت کننده ها سازمان جهانی بهداشت توصیه می کند که افراد بالای 60 سال که سینوفارم دریافت می کنند واکسن تقویت کننده با همان واکسن یا واکسن دیگر تزریق کنند.
در ماه مه 2021، نگرانی هایی در مورد اثربخشی واکسن در امارات متحده عربی پدیدار شد. در پاسخ، دولت اعلام کرد که برای افرادی که دو دوز BBIBP-CorV دریافت کردهاند واکسنهای تقویتی ارائه میکند. بحرین در 3 ژوئن اعلامیه مشابهی را دنبال کرد. در 29 اوت، امارات متحده عربی. تزریقات تقویت کننده اجباری برای همه ساکنانی که BBIBP-CorV دریافت کرده اند. نماینده سینوفارم در W.H.O گزارش داد. در اکتبر جلسه ای انجام شد که یک تقویت کننده پس از دو دوز، سطح آنتی بادی را بیش از اوج خود سه برابر کرد.
برای جزئیات بیشتر، نحوه عملکرد واکسن سینوفارم را ببینید.
تایید شده برای استفاده در: بحرین، چین، امارات متحده عربی.
استفاده اضطراری در: الجزایر، آنگولا، آرژانتین، ارمنستان NEW، بنگلادش، بلاروس، بلیز، بوتان، بولیوی، برزیل، برونئی، بورکینافاسو NEW، بوروندی جدید، کامبوج، کامرون، چاد، کومور، کوبا جدید، دومینیکا، مصر، استوایی گینه، اتیوپی، گابن، گامبیا، گرجستان، گینه، گویان، مجارستان، اندونزی، ایران، عراق، اردن، قزاقستان NEW، کنیا، قرقیزستان، لائوس، لبنان، ماکائو، مالاوی، مالزی، مالدیو، موریتانی، موریس، مکزیک، مولداوی ، مغولستان، مونته نگرو، مراکش، موزامبیک، میانمار، نامیبیا، نپال، نیجر، نیجریه، مقدونیه شمالی، پاکستان، پاپوآ گینه نو، پاراگوئه، پرو، فیلیپین (شامل Hayat-Vax)، جمهوری کنگو، رواندا، عربستان سعودی، سنگال، صربستان، سیرالئون، جزایر سلیمان، سومالی، آفریقای جنوبی NEW، سریلانکا، سودان، تایلند، ترینیداد و توباگو، تونس، ترکمنستان، ویتنام (شامل Hayat-Vax)، ونزوئلا، کرانه باختری و نوار غزه، وانواتو NEW، زیمبابوه تایید استفاده اضطراری از سازمان بهداشت جهانی.
استفاده محدود در: صربستان، سیشل.
Covaxin، تولید شده توسط Bharat Biotech، اولین واکسن کووید-19 بود که در هند تولید شد و مجوز استفاده اضطراری را دریافت کرد. هند در آوریل 2021 آن را تأیید کرد و سازمان بهداشت جهانی در 3 نوامبر فهرست استفاده اضطراری را به آن داد.
توسعه واکسن محققان در شورای تحقیقات پزشکی هند و موسسه ملی ویروس شناسی، کواکسین را از کروناویروس های غیرفعال طراحی کردند. مطالعات انجام شده در بهار 2021 بر روی میمون ها و همسترها نشان داد که این واکسن برای حیوانات در برابر عفونت محافظت می کند.
نتایج کارآزمایی Bharat Biotech آزمایشهای بالینی را در ژوئن 2020 راهاندازی کرد. آزمایش فاز 1/2 نشان داد که واکسن هیچ عارضه جانبی جدی در حین تولید آنتیبادی برای ویروس کرونا ایجاد نکرده است. یک مطالعه پیگیری این نتایج را تایید کرد. در 23 اکتبر، این شرکت اعلام کرد که فاز 3 آزمایشی را آغاز کرده و در نهایت بیش از 25800 داوطلب را استخدام کرد.
Bharat Biotech تنها در مارس 2021، دو ماه پس از دریافت مجوز اضطراری واکسن، انتشار نتایج آزمایش را آغاز کرد. نتایج نهایی در تاریخ 2 ژوئیه به صورت آنلاین منتشر شد و در 11 نوامبر در Lancet ظاهر شد. این واکسن دارای اثربخشی 77.8 درصدی در برابر Covid-19 علامتی بود، و اثربخشی آن در برابر Covid-19 شدید 93.4 درصد بود. برای بیماری بدون علامت، این واکسن دارای اثربخشی 63.6 درصد بود که نشان میدهد میتواند انتقال را نیز کند کند.
در ژوئن، Bharat Biotech آزمایشی را بر روی کودکان 2 ساله ثبت کرد. نتایج آن کارآزمایی که در اواخر دسامبر منتشر شد، نشان داد که Covaxin در کودکان موثرتر از بزرگسالان است.
مقامات هندی در 11 آگوست اعلام کردند که به Bharat اجازه خواهند داد آزمایشی را انجام دهد که Covaxin را با BBV154، واکسن داخل بینی این شرکت، مخلوط می کند. دو روز بعد، آنها اعلام کردند که BBV154 مجوز شروع آزمایشات فاز 2/3 را به تنهایی دریافت کرد.
این شرکت در 12 ژانویه گفت که Covaxin به عنوان یک تقویت کننده در برابر انواع برجسته مانند Delta و Omicron عمل می کند. مجوز در 3 ژانویه 2021، دولت هند مجوز اضطراری Covaxin را صادر کرد. فقط یک سال بعد در ژانویه 2022، تایید کامل واکسن را صادر کرد. کشورهای دیگر در آفریقا، آسیا و آمریکای جنوبی بعداً این واکسن را مجاز کردند. در برزیل، مناقشه بر سر فساد باعث شد تا دولت مجوز کوواکسین را در جولای 2021 به حالت تعلیق درآورد.
Bharat Biotech با Ocugen مستقر در پنسیلوانیا برای توسعه Covaxin برای بازار ایالات متحده مشارکت کرد. در ژوئن 2021، Ocugen اعلام کرد که بهجای مجوز استفاده اضطراری، به دنبال مجوز کامل برای واکسن است. این شرکت در 27 اکتبر گفت که درخواستی را به F.D.A ارسال کرده است. برای اجرای فاز 3 آزمایشی روی کوواکسین در ایالات متحده، و در نوامبر Ocugen مجوز استفاده اضطراری را برای کودکان زیر 2 سال درخواست کرد. در 3 نوامبر، Covaxin اولین واکسن هندی بود که مجوز استفاده اضطراری را از سازمان بهداشت جهانی دریافت کرد.
توزیع بهارات انتظار دارد پس از افزایش ظرفیت تولید خود، سالانه یک میلیارد دوز کواکسین تولید کند.
VARIANTSBharat آزمایشات بالینی خود را در هند انجام داد، درست زمانی که نوع دلتا در کشور در حال افزایش بود. در نتیجه، آنها توانستند اثربخشی Covaxin در برابر دلتا را با بررسی خطر نسبی که داوطلبان برای ابتلا به این نوع داشتند محاسبه کنند. آنها برآورد کردند که اثربخشی آن 65.2 درصد بود.
دلتا متعاقباً به دودمان جدید، از جمله AY.1، که گاهی اوقات به عنوان دلتا پلاس شناخته می شود، تکامل یافت. محققان دریافتند که آنتیبادیهای افرادی که با کواکسین واکسینه شدهاند، میتوانند کروناویروس AY.1 را خنثی کنند.
برای جزئیات بیشتر، نحوه عملکرد واکسن Bharat Biotech را ببینید.
تایید شده برای استفاده در: هند جدید.
استفاده متوقف شد: واردات برزیل به حالت تعلیق درآمد.
استفاده اضطراری در: بحرین جدید، بوتسوانا، گواتمالا، گویان، هنگ کنگ، ایران، موریس، مکزیک، نپال، نیکاراگوئه، پاراگوئه، فیلیپین، ترینیداد و توباگو، ونزوئلا، ویتنام، زیمبابوه. تایید استفاده اضطراری از سازمان بهداشت جهانی.
محققان موسسه زیست پزشکی در آکادمی علوم پزشکی چین که واکسن فلج اطفال و هپاتیت A را اختراع کرده است ، یک واکسن ویروس کرونا ویروس غیرفعال ایجاد کردند. در ماه مه سال 2020 ، آنها یک آزمایش فاز 1 را روی 192 داوطلب آغاز کردند که نشان می داد واکسن ایمن است و پاسخ ایمنی ایجاد می کند. یک آزمایش فاز 2 روی 750 داوطلب دنبال شد ، که محققان را به انتخاب فاصله دو هفته ای بین دو دوز واکسن سوق داد. در ماه دسامبر محققان یک آزمایش فاز 3 را در مورد 34،020 داوطلب در برزیل و مالزی آغاز کردند. در تاریخ 9 ژوئن ، روزنامه دولت چین Science and Technology Daily گزارش داد که واکسن مجوز استفاده اضطراری را دریافت کرده است.
Updated June 10قزاقستان در آسیای مرکزی تحقیقات خود را در مورد واکسنی که از کروناویروس های غیر فعال تهیه شده است ، در تابستان آغاز کرد. در 28 آگوست 2020 ، م Instituteسسه تحقیقاتی آنها در زمینه مشکلات ایمنی زیستی آزمایش فاز 1 این واکسن را ثبت کرد. در 19 دسامبر ، Kazinform گزارش داد که محققان مرحله دوم آزمایش را تکمیل کرده و دریافتند که واکسن بی خطر است و پاسخ ایمنی امیدوار کننده ای ایجاد می کند. محققان آزمایش فاز 3 را در ماه مارس آغاز کردند ، معاون وزیر آموزش و علوم قزاقستان اعلام کرد که با وجود عدم انتشار نتایج آزمایش فاز 3 ، انتظار می رود واکسن معروف به QazVac در آوریل مجاز شود.
قزاقستان از واکسن خود برای مردم در اواخر آوریل شروع کرد. در 29 ژوئیه ، مقامات دولتی اعلام کردند که 25000 دوز واکسن را به کشور همسایه قرقیزستان تحویل می دهند.
محققان این موسسه گزارشی از آزمایش فاز 3 خود را در ژانویه 2022 منتشر کردند. آنها دریافتند که این واکسن اثربخشی 82 درصدی در برابر عفونت دارد. کارآزمایی برای تعیین اثربخشی در برابر بیماری شدید بسیار کوچک بود. این مطالعه هنوز در یک مجله علمی منتشر نشده است.
استفاده زود هنگام: قزاقستان.
Updated Feb. 7در تاریخ 18 آگوست ، رئیس اپیدمیولوژی وزارت بهداشت عمومی کوبا از اولین آزمایش آزمایش واکسن Covid-19 در این کشور خبر داد. موسسه واکسن Finlay در هاوانا آزمایش واکسنی به نام Soberana 1. را آغاز کرد. این ماده حاوی بخشی از پروتئین سنبله به نام RBD به همراه دو ماده اضافی است: پروتئین های باکتری و هیدروکسید آلومینیوم. این مواد ، که به عنوان کمکی شناخته می شوند ، پاسخ سیستم ایمنی بدن به ویروس کرونا را افزایش می دهند.
در 26 جولای، رسانه های کوبا گزارش دادند که Soberana 1 وارد فاز 2 آزمایشی شده است.
در ماه نوامبر، مقامات بهداشتی کوبا آزمایش بالینی را برای استفاده از Soberana 1 به عنوان دوز تقویت کننده تایید کردند. نتایج حاصل از آزمایش فاز 1 نشان می دهد که Soberana 1 می تواند به طور ایمن ایمنی ایجاد کند، و در صورت ترکیب با Abdala، می تواند با نوع Omicron مبارزه کند.
شرکت بیوتکنولوژی ایتالیایی ReiThera یک واکسن Covid-19 به نام GRAd-COV2 تولید کرده است که بر اساس ویروس آدنو ویروس آلوده به گوریل ها ساخته شده است. آنها که با همکاری م Instituteسسه ملی بیماریهای عفونی Lazzaro Spallanzani در رم کار می کردند ، دریافتند که این ماده مقادیر زیادی آنتی بادی در موش و میمون تولید می کند. در ژوئیه سال 2020 ، آنها یک آزمایش بالینی فاز 1 را آغاز کردند. در ماه نوامبر ، آنها اعلام کردند که واکسن به خوبی تحمل شده و آنتی بادی تولید می کند و گزارشی از آزمایش را منتشر کردند.
در مارس 2021 ، محققان آزمایش واکسن فاز 2 را آغاز کردند. اما در ماه مه ، رویترز گزارش داد ، دادگاهی در ایتالیا طرح دولت برای تأمین بودجه آزمایش فاز 3 را لغو کرد و تولید واکسن را به تردید انداخت. بعداً دولت گفت آماده بودجه واکسن است.
Updated July 12نام واکسن: عبدالا
کارآیی: 92.28
در نوامبر 2020 ، مرکز مهندسی ژنتیک و بیوتکنولوژی کوبا آزمایش واکسن کرونا به نام عبدالا را آغاز کرد. این نام از شعری از شاعر قرن نوزدهم خوزه مارتی گرفته شده است. واکسن عبدالا شامل یک قطعه از پروتئین سنبله کروناویروس به نام دامنه اتصال گیرنده است و در سه دوز تحویل داده می شود. در 1 فوریه ، این مرکز یک کنفرانس مطبوعاتی را برای اعلام شروع آزمایش مرحله 2 برگزار کرد. مرحله آزمایشی مرحله 3 با حضور 48000 شرکت کننده در 18 مارس آغاز شد. در 12 مه ، در حالی که محاکمه مرحله 3 هنوز در حال انجام بود ، دولت کوبا شروع به استفاده از عبدالا در کمپین واکسیناسیون دسته جمعی کرد ، به امید مهار موج شدید موارد ونزوئلا استفاده از واکسن را در اواخر ژوئن آغاز کرد. در 21 ژوئن ، مقامات کوبا گزارش دادند که اثر ابدالا 92.28 درصد است. مقامات کوبا در 1 ژوئیه محاکمه ابدالا در جوانان را تأیید کردند. در 9 ژوئیه ، دولت کوبا مجوز استفاده اضطراری از واکسن را صادر کرد. عبدالا یکی از دو واکسن کوبائی است که در مرحله 1/2 کارآزمایی بالینی مورد آزمایش قرار گرفته است تا توانایی آنها در افزایش ایمنی در افرادی که قبلاً به کووید -19 مبتلا بوده اند مورد ارزیابی قرار گیرد.
استفاده اضطراری در: کوبا ، ونزوئلا جدید.
Updated Aug. 4پس از شیوع سارس در سال 2002 ، محققان کالج پزشکی بیلور شروع به تولید واکسنی کردند که می تواند از شیوع جدید جلوگیری کند. با وجود نتایج امیدوار کننده اولیه ، حمایت از تحقیقات از بین رفت. از آنجا که ویروس های کرونا ویروس های ایجاد کننده SARS و Covid-19 بسیار شبیه به هم هستند ، محققان با همکاری بیمارستان کودکان تگزاس این پروژه را احیا کردند.
شرکت هندی Biological E در ماه آگوست مجوز آن را صادر کرد و یک آزمایش آزمایشی فاز 1/2 را در ماه نوامبر با ترکیب پروتئین های ویروسی و مواد کمکی ساخت Dynavax آغاز کرد. در تاریخ 29 دسامبر ، Biological E و ائتلاف برای ابتکارات آمادگی اپیدمیک همکاری برای پیشبرد تولید و ساخت واکسن ، معروف به BECOV2 را اعلام کردند ، که CEPI در ابتدا 5 میلیون دلار به این تلاش کمک کرد.
در 24 آوریل 2021، Biological E اعلام کرد که فاز 3 آزمایش این واکسن را آغاز کرده است. Biological E برای فاز 2/3 آزمایشی Corbevax روی کودکان در 2 سپتامبر تأیید شد.
در 28 دسامبر، Biological E اعلام کرد که مجوز اضطراری را از دولت هند بر اساس نتایج آزمایشی فاز 3 خود دریافت کرده است. آنها گزارش دادند که عملکرد بهتری نسبت به Covishield، نسخه هندی واکسن AstraZeneca دارد، در حالی که باعث ایجاد نیمی از عوارض جانبی گزارش شده است. بر اساس سطح آنتی بادی های تولید شده توسط افرادی که با Corbevax واکسینه شده اند، این شرکت اثربخشی آن را بیش از 90 درصد در برابر نسخه اصلی نوع تخمین زده است. نتایج کامل آزمایش فاز 3 در یک دستنوشته علمی منتشر خواهد شد.
Corbevax از فناوری استاندارد واکسیناسیون پروتئینی استفاده می کند که به طور گسترده در سراسر جهان در دسترس است و تولید آن را نسبتاً ارزان و آسان می کند. Biological E در بیانیه 28 دسامبر خود گفت که قصد دارد 300 میلیون دوز را در اوایل سال 2022 به دولت هند تحویل دهد و یک میلیارد دوز اضافی را در سراسر جهان تحویل دهد. پیش از این در سال 2021، دولت بایدن متعهد شد که توانایی تولید Biological E را به طور قابل توجهی افزایش دهد تا به هدف خود کمک کند.
Updated Dec. 28

در اوایل سال 2020، سانوفی واکسن کووید-19 را بر اساس پروتئینهای ویروسی که با ویروسهای مهندسی شده تولید میکردند تولید کرد که در داخل سلولهای حشرات رشد میکنند. GSK این پروتئین ها را با ادجوانت هایی که سیستم ایمنی را تحریک می کنند تکمیل کرد. این واکسن که Vidprevtyn نام دارد بر اساس همان طرحی است که Sanofi برای ساخت Flublok، واکسن تایید شده برای آنفولانزا، استفاده کرد. این شرکتها آزمایش بالینی فاز 1/2 را در سپتامبر 2020 راهاندازی کردند.
انتظار می رفت که Vidprevtyn نقش مهمی در مقابله با همه گیری ایفا کند. در ایالات متحده، عملیات Warp Speed آن را به عنوان یکی از شش واکسن برای ایمن سازی در مقادیر زیاد انتخاب کرد و به توافقی 2.1 میلیارد دلاری برای 100 میلیون دوز دست یافت. در 18 سپتامبر سانوفی قرارداد دیگری با اتحادیه اروپا برای 300 میلیون دوز برای مقدار نامشخصی منعقد کرد و بعداً با کانادا برای 72 میلیون دوز به توافق رسید. علاوه بر این، سانوفی موافقت کرد که 200 میلیون دوز برای COVAX، یک همکاری بینالمللی برای تحویل عادلانه واکسن در سراسر جهان، ارائه کند. این شرکت انتظار داشت در ماه دسامبر به فاز 3 آزمایشی منتقل شود و احتمالاً تا بهار 2021 به دنبال مجوز استفاده اضطراری برای Vidprevtyn در ایالات متحده باشد. سانوفی اعلام کرد که قصد دارد تا یک میلیارد دوز در سال 2021 ایجاد کند.
اما در 11 دسامبر 2020، Sanofi و GSK اعلام کردند که Vidprevtyn ناامیدکننده است. در حالی که سطوح امیدوارکننده ای از آنتی بادی ها را در افراد زیر 50 سال ارائه می کرد، افراد مسن تر به آن شدتی که انتظار داشتند پاسخ ندادند. شرکت آزمایشی را متوقف کرد. در ژانویه سانوفی تصمیم گرفت به فایزر و BioNTech کمک کند تا 100 میلیون دوز از واکسن خود را تولید کنند و آنها به توافقی مشابه با جانسون و جانسون در ماه فوریه دست یافتند.
در همین حال، سانوفی فرمول قوی تری از Vidprevtyn را توسعه داد. در 22 فوریه، شرکت فاز 2 آزمایشی جدیدی را راه اندازی کرد که نشان داد نسخه جدید پاسخ های ایمنی قوی ایجاد می کند. آنها شروع به ثبت نام شرکت کنندگان برای فاز 3 آزمایشی خود در 27 مه کردند. در 20 ژوئیه 2021، آژانس دارویی اروپا یک بررسی چرخشی از Vidprevtyn را قبل از درخواست آنها برای مجوز آغاز کرد. سانوفی در گزارشی از درآمد در 28 اکتبر گفت که انتظار داشت نتایج آزمایشی فاز 3 جدید خود را تا پایان سال 2021 نشان دهد، اما در 15 دسامبر، این شرکت اعلام کرد که این آزمایش تا اوایل سال 2022 ادامه خواهد داشت زیرا تعداد بسیار کمی از شرکت کنندگان به بیماری مبتلا شده اند. کووید 19. با این حال، نتایج یک آزمایش تقویت کننده امیدوارکننده بود. داوطلبان واکسینه شده که واکسن شرکت را به عنوان یک تقویت کننده دریافت کردند، شاهد افزایش زیادی در آنتی بادی های ضد ویروس کرونا بودند.
Updated Dec. 16در ماه جولای گذشته ، محققان در بیمارستان West China University of Sichuan مطالعه ای در Nature منتشر کردند که در آن واکسنی از منطقه RBD پروتئین سنبله ساخته شده است که می تواند موش ها و میمون ها را از ویروس کرونا محافظت کند. برای ساخت واکسن ، محققان ناحیه RBD را در یک ژن رمزگذاری کردند که آن را وارد ویروس کردند. آنها سپس سلول های حشرات را به ویروس آلوده کردند و باعث شدند مولکول به مقدار زیاد ساخته شود. در 24 آگوست ، آنها آزمایش فاز 1 را آغاز کردند و در 16 نوامبر با مطالعه روی 960 داوطلب به فاز 2 نقل مکان کردند. در 22 ژانویه ، 20201 ، محققان آزمایش فاز 2 دیگر را با 4000 داوطلب ثبت کردند. دادگاه فاز 3 از اول ژوئن آغاز شد.
Updated June 1Shenzhen Kangtai Biological Products یک شرکت چینی است که برای بیماری هایی مانند هپاتیت B و سرخک واکسن می سازد. در ماه اوت ، AstraZeneca با وجود شنیده ها مبنی بر فساد و رسوایی هایی که باعث آزار این شرکت شده است ، با Shenzhen به توافق رسید تا واکسن آدنوویروس خود را به چین عرضه کند. در اکتبر شنژن کانگتای آزمایش فاز 1 را بر روی 180 داوطلب واکسن خود ، بر اساس ویروس های غیرفعال ، آغاز کرد. در فوریه 2021 این شرکت یک آزمایش فاز 2 را دنبال کرد و یک آزمایش فاز 3 را نیز در ماه مه آغاز کرد. در همان ماه ، این شرکت اعلام کرد که دولت چین به آن اجازه استفاده اضطراری را داده است. اولین داوطلبان در 21 ژوئن در مالزی آمپول زدند.
در ماه مه، این شرکت همچنین اعلام کرد که دولت چین حتی قبل از شروع فاز 3 آزمایشی، مجوز استفاده اضطراری را به آن داده است. در نوامبر 2021، اندونزی واکسن Kangtai را مجاز کرد و این شرکت گفت که 4 میلیون دوز را به آنجا ارسال کرده است - علیرغم عدم وجود نتایج آزمایشی عمومی فاز 3.
استفاده اضطراری در: چین.
Updated Dec. 8سازنده واکسن فرانسوی Valneva واکسنی از ویروسهای کروناویروس غیرفعال شیمیایی با استفاده از کمکی از Dynavax ایجاد کرد. این واکسن که VLA2001 نام دارد، در حال حاضر تنها واکسن ویروس غیرفعال است که در اروپا ساخته شده است. در 16 دسامبر 2020، والنووا فاز 1/2 آزمایشی را در بریتانیا راهاندازی کرد. دو ماه بعد، در فوریه 2021، دولت بریتانیا به توافقی مبنی بر خرید 100 میلیون دوز از واکسن در صورت اثبات ایمن و مؤثر بودن، با گزینه ای برای خرید 90 میلیون دوز دیگر دست یافت - معامله ای که بالقوه بیش از یک میلیارد دلار ارزش دارد.
در ماه آوریل، این شرکت اعلام کرد که آزمایش نتایج مثبتی داشته است و فاز 3 آزمایشی را روی 4000 داوطلب در بریتانیا راه اندازی کرد. این کارآزمایی با موج اول مطالعات بر روی واکسنهای کووید-19 که در آن برخی از داوطلبان واکسن و بقیه دارونما دریافت کردند، متفاوت بود. با افزایش تعداد واکسنهای مجاز برای استفاده در بریتانیا، چنین آزمایشهای بالینی تصادفیسازی شده دیگر اخلاقی نبودند. در عوض، والنووا VLA2001 را به نیمی از داوطلبان خود داد، در حالی که بقیه واکسزوریا، واکسن ساخته شده توسط AstraZeneca را دریافت کردند. سپس محققان مشاهده کردند که آیا VLA2001 سطوح مشابهی از آنتی بادیهای Vaxzevria تولید میکند یا خیر.
در 18 اکتبر، والنووا نتایج اصلی آزمایش را اعلام کرد. در مقایسه با Vaxzevria، واکسن VLA2001 آنها 40 درصد سطوح بالاتری از آنتی بادیهایی تولید کرد که ویروس کرونا را خنثی میکرد. همچنین عوارض جانبی کمتری ایجاد کرد.
با وجود این نتایج امیدوارکننده، آینده VLA2001 نامشخص است. در ماه اوت، والنووا شروع به درخواست مجوز در بریتانیا کرد، اما ماه بعد، دولت بریتانیا قرارداد خود را لغو کرد و ادعا کرد که شرکت تعهدات خود را نقض کرده است - اتهامی که والنووا آن را رد می کند. والنووا در اعلام نتایج آزمایشی فاز 3 خود گفت که درخواست خود را در بریتانیا به پایان خواهد رساند و به سمت درخواست به آژانس دارویی اروپا حرکت خواهد کرد. در 24 نوامبر، این شرکت اعلام کرد که یک قرارداد پیش خرید با کمیسیون اروپا برای تامین حداکثر 60 میلیون دوز VLA2001 طی دو سال امضا کرده است. به شرط مجاز بودن واکسن، Valneva انتظار دارد 24.3 میلیون دوز را در نیمه دوم سال 2022 تحویل دهد. Valneva در 29 نوامبر اعلام کرد که با IDT Biologika برای تولید دوزها در آلمان و اسکاتلند همکاری خواهد کرد. و در 8 دسامبر، والنووا گفت که یک قرارداد خرید پیشرفته با بحرین برای حداکثر یک میلیون دوز از واکسن خود امضا کرده است.
نتایج حاصل از کارآزمایی COV-Boost در بریتانیا، که اثربخشی هفت واکسن را بهعنوان تقویتکننده برای افرادی که دو دوز Comirnaty یا Vaxzevria دریافت کردهاند مقایسه کرد، نشان داد که واکسن Valneva کمترین عملکرد را در ایجاد پاسخ ایمنی دارد. در بیانیه 3 دسامبر، والنووا گفت که فاصله کوتاه بین دوز دوم و تزریق تقویت کننده در طول آزمایش می تواند مقصر نتایج ناامیدکننده باشد. والنووا در کارآزمایی تقویتکننده خود گفت که تزریق واکسن هفت تا هشت ماه پس از دو دوز VLA2001 به طور قابلتوجهی باعث افزایش ایمنی شد. Valneva اکنون در حال برنامه ریزی برای راه اندازی آزمایش دیگری برای تقویت کننده در افراد بیش از شش ماه پس از دریافت واکسن متفاوت یا به دست آوردن ایمنی طبیعی است. این شرکت در 6 ژانویه اعلام کرد که نتایج اولیه یک کارآزمایی در افراد مسن در هفته های آینده انتظار می رود.
نتایج اولیه یک مطالعه آزمایشگاهی که در 19 ژانویه منتشر شد، نشان میدهد که واکسن والنووا در برابر نوع Omicron نسبت به سایر انواع کمتر موثر است.
Updated Jan. 19در تاریخ 10 دسامبر ، نانوژن Biopharmaceutical در ویتنام شروع به استخدام 60 داوطلب برای آزمایش فاز 1 واکسن مبتنی بر پروتئین Nanocovax کرد. آژانس های خبری ویتنام اعلام کردند که Nanocovax در فوریه وارد دادرسی فاز 2 شد. در ماه ژوئن ، نانوژن یک آزمایش فاز 3 را آغاز کرد.
نتایج اولیه امیدوارکننده از آزمایش، شرکت را به سرعت بخشیدن به روند مجوز استفاده اضطراری در ویتنام سوق داده است.
شفا فارمد پارس ، یک شرکت دارویی ایرانی ، واکسنی ساخته شده از ویروس های کرونا ویروس غیرفعال ساخته است. نتایج حاصل از آزمایشات بالینی نشان داد که واکسن در حیوانات ایمن و م effectiveثر است. این واکسن که به عنوان COVIran Baretat شناخته می شود ، در اواخر ماه دسامبر وارد آزمایش فاز 1 شد و به اولین واکسن تولید شده در ایران برای آزمایش بالینی تبدیل شد. COVIran Baretat آزمایش فاز 3 را در 25 آوریل آغاز کرد و در 14 ژوئن ، دولت ایران اعلام کرد که واکسن را مجاز کرده است ، با وجود این واقعیت که بسیاری از داوطلبان در آزمایش فاز 3 هنوز دوز دوم خود را دریافت نکرده اند. در 25 ژوئن ، آیت الله خامنه ای واکسن COVIran Baretat را از تلویزیون دریافت کرد.
استفاده اضطراری در: ایران.
Updated June 30در تاریخ 5 نوامبر ، دانشگاه Erciyes ترکیه اعلام کرد که تزریق واکسن ویروس کرونا غیرفعال به نام ERUCOV-VAC را به داوطلبان آغاز کرده اند. این اولین آزمایش بالینی واکسن ویروس کرونا در ترکیه بود. در 14 دسامبر ، رئیس دانشگاه گفت که آزمایش مرحله 1 کامل است. صبح امروز ماه بعد گزارش داد که آزمایش های فاز 2 آغاز شده است. در 23 ژوئن ، رجب طیب اردوغان ، رئیس جمهور ترکیه اعلام کرد که این واکسن ، به نام Turkovac تغییر نام داده است ، وارد آزمایش فاز 3 شده است.
در ژوئیه، محققان یک آزمایش فاز 2 را برای ارزیابی واکسن به عنوان یک تزریق تقویت کننده ثبت کردند و به مرحله آزمایشی فاز 3 در 14 اکتبر رفتند. Turkovac همچنین در یک کارآزمایی تقویت کننده برای افرادی که واکسن mRNA را دریافت کرده بودند مورد ارزیابی قرار گرفت. محققان کارآزمایی تقویتکننده دیگری را در 27 ژانویه 2022 ثبت کردند که در آن از Turkovac در شرکتکنندگانی که Comirnaty دریافت کردهاند استفاده خواهد شد. آنها همچنین آزمایشی را در 9 فوریه ثبت کردند که اثربخشی واکسن را در نوجوانان در برابر CoronaVac مقایسه کرد.
در 23 دسامبر 2021، ترکیه اعلام کرد که مجوز استفاده اضطراری را به Turkovac می دهد. قرار ملاقات ها برای شات در 30 دسامبر آغاز شد و ترکیه در ژانویه 2022 شروع به دادن تورکواچ به عنوان تقویت کننده کرد.
هنگامی که Turkovac راه اندازی شد، انجمن های پزشکی ترکیه از دولت درخواست کردند که نتایج آزمایش فاز 3 را علنی کند. هنوز مشخص نیست Turkovac چقدر ایمن و موثر است، اما رهبر توسعه آن در کنفرانسی در 25 ژانویه 2022 ادعا کرد که می تواند در برابر انواع آلفا و دلتا محافظت کند.
Updated Feb. 9واکسن Bacillus Calmette-Guerin در اوایل دهه 1900 به عنوان محافظ در برابر سل ساخته شد. موسسه تحقیقات کودکان مورداک در استرالیا در حال انجام آزمایش فاز 3 به نام BRACE است تا ببیند آیا این واکسن تا حدی از ویروس کرونا محافظت می کند یا خیر.
به روز شدهاستفاده محدود
نام واکسن: Comirnaty (همچنین به عنوان tozinameran یا BNT162b2 نیز شناخته می شود)
کارایی: 95٪
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
ذخیره سازی: ذخیره سازی فریزر فقط در –94 درجه فارنهایت (–70 درجه سانتیگراد)
سازمان بهداشت جهانی این واکسن را تایید کرده است.
در تاریخ 9 نوامبر ، Pfizer مستقر در نیویورک و شرکت آلمانی BioNTech با اعلام اینکه میزان اثر بخشی واکسن ویروس کرونا بیش از 90 درصد است ، بسیار فراتر از انتظار است ، تاریخ سازی کردند. این اولین باری بود که کسی چنین شواهدی را پیدا می کرد. بیش از یک ماه بعد ، در 11 دسامبر ، سازمان غذا و دارو اولین مجوز استفاده اضطراری را که ایالات متحده به واکسن ویروس کرونا داده است ، اعطا کرد. در 10 مه F.D.A. مجوز را برای کودکان 12 ساله گسترش داد.
کار بر روی واکسن در ژانویه سال 2020 آغاز شد ، زمانی که محققان BioNTech شروع به ساختن یک مولکول ژنتیکی به نام RNA پیام رسان (mRNA) کردند. آنها دستورالعمل های ژنتیکی ساخت پروتئین ویروس کرونا را ایجاد کردند ، معروف به سنبله. هنگامی که به سلول ها تزریق می شود ، واکسن باعث ایجاد پروتئین های سنبله ای می شود و سپس در بدن آزاد می شود و پاسخ سیستم ایمنی بدن را تحریک می کند. در ماه مارس ، BioNTech با همکاری Pfizer برای گسترش تحقیقات ، یک آزمایش بالینی را در ماه مه آغاز کرد. آنها به واکسن نام عمومی tozinameran و نام تجاری Comirnaty دادند
در آزمایشات فاز 1 ، محققان دریافتند که Comirnaty باعث تولید داوطلبان آنتی بادی علیه SARS-CoV-2 و همچنین سلولهای ایمنی به نام سلولهای T می شود که به ویروس پاسخ می دهند. در تاریخ 27 ژوئیه ، شرکت ها از آغاز آزمایش فاز 2/3 با حضور 30،000 داوطلب خبر دادند. در 12 سپتامبر ، Pfizer و BioNTech اعلام کردند که به دنبال گسترش دادگاه برای 44000 شرکت کننده هستند.
در طول تابستان و پاییز ، جهان توجه خود را بیشتر به محاکمه Pfizer-BioNTech معطوف کرد. در ماه سپتامبر ، دکتر آلبرت بورلا ، مدیر اجرایی Pfizer ، گفت که به محض ماه اکتبر ، آزمایش فاز 3 نتایج کافی را به دست می دهد تا نشان دهد که آیا واکسن م workedثر است یا خیر. پرزیدنت ترامپ با اشاره به وجود واکسن قبل از انتخابات ، پیشرفت آنها را تبلیغ کرد. اما در تاریخ 27 اکتبر ، دکتر بورلا اعلام کرد که داوطلبان حاضر در این آزمایش هنوز موارد کافی Covid-19 را برای تعیین کارایی واکسن ها تجربه نکرده اند. سرانجام ، در تاریخ 9 نوامبر ، Pfizer و BioNTech تجزیه و تحلیل اولیه خود را در مورد 94 مورد اول منتشر کردند.
طی یک ماه آینده ، Pfizer و BioNTech اطلاعات بیشتری در مورد موارد بیشتر منتشر کردند. در 8 دسامبر ، FDA تجزیه و تحلیل مستقل خود را از آزمایشات بالینی منتشر کرد. آنها تشخیص دادند که میزان Comirnaty 95 درصد است. در حالی که Comirnaty هیچ عارضه جانبی جدی ایجاد نکرد ، اما اغلب باعث خستگی کوتاه مدت ، تب و درد عضلانی می شود.
در تاریخ 2 دسامبر ، انگلستان مجوز اضطراری واکسن Pfizer و BioNTech را صادر کرد و در پی آن کشور های بیشتری به آن واگذار شدند. در تاریخ 31 دسامبر ، سازمان بهداشت جهانی واکسن را لیست استفاده اضطراری قرار داد ، که به سرعت مجوز آن در سراسر جهان سرعت می بخشد. در اسرائیل ، که پیشتاز واکسیناسیون دسته جمعی بود ، محققان دریافتند که این واکسن در دنیای واقعی همانطور که آزمایشات نشان داده است ، م wasثر است. مطالعه منتشر شده توسط مراکز کنترل بیماری در ماه مارس نشان داد که این واکسن بعد از دوز دوم 3/91٪ موثر است. در 7 مه ، Pfizer و BioNTech اعلام کردند که به دنبال F.D.A کامل هستند. تأیید واکسن آنها انتظار می رود روند این کار چند ماه طول بکشد.
با پیشرفت آزمایش ها ، Pfizer و BioNTech همچنین کارخانه های تولید Comirnaty را در مقادیر زیاد افزایش دادند. دولت ترامپ برای اطمینان از عرضه پیش از آن ، در ژوئیه 2020 به 100 میلیون دوز قرارداد 1.9 میلیارد دلاری به Pfizer و BioNTech اعطا کرد ، اما روزنامه نیویورک تایمز در ماه دسامبر گزارش داد که دولت این فرصت را در تابستان برای تأمین 100 میلیون دوز دیگر به دست آورد. . از آن زمان به بعد ، دولت های ترامپ و بایدن توافقاتی را برای مجموع 300 میلیون دوز تا تابستان به دست آوردند. در آوریل 2021 ، اتحادیه اروپا برای معامله 1.8 میلیارد دوز مذاکره کرد ، که باید کمبود بزرگی را که در اوایل انتشار واکسن تجربه کردند ، کاهش دهد. در کل ، BioNTech و Pfizer انتظار دارند در سال 2021 نزدیک به 3 میلیارد دوز تولید کنند.
در حالی که Comirnaty بسیار م provenثر بوده است ، در ابتدا توزیع این واکسن چالش برانگیز بود زیرا باید در دمای 94- درجه فارنهایت (70- درجه سانتیگراد) منجمد نگه داشته می شد. در 19 فوریه ، Pfizer و BioNTech اعلام کردند که می توانند واکسن را در دمای 25- تا 15- درجه سانتیگراد (-13 درجه فارنهایت تا 5 درجه فارنهایت) پایدار نگه دارند.
در ژانویه ، دانشمندان در مورد ظهور انواع سریع گسترش یافته که ممکن است قادر به فرار از آنتی بادی ها باشند ، نگران شدند. مطالعه ای که در ماه مه منتشر شد ، نشان داد كه Comirnaty در برابر برخی از انواع تا حدودی م effectiveثر است ، اما با این وجود محافظت شدیدی دارد. تحقیقات بعدی همچنین نشان داد که Pfizer از محافظت خوبی در برابر Delta ، گونه ای که برای اولین بار در هند شناسایی شد ، برخوردار است.
Comirnaty در حال حاضر در تعدادی آزمایش دیگر مورد آزمایش قرار گرفته است. در فوریه 2021 ، شرکت ها مطالعه ای را برای توسعه یک تقویت کننده خاص بتا اعلام کردند. آنها همچنین یک آزمایش به طور خاص برای زنان باردار و همچنین کودکان بین 5 تا 11 سال دارند. در 30 ژوئن ، پس از نتایج مثبت از محاکمه جوانان ، فایزر گفت که تصویب تصویب اضطراری برای استفاده در کودکان از همان اوایل سپتامبر. در ماه ژوئن ، محققان در آکسفورد نتایج اولیه را اعلام کردند که ترکیبی از واکسن AstraZeneca و به دنبال آن Comirnaty ، مقادیر زیادی آنتی بادی تولید می کند.
دکتر بورلا ، رئیس اجرایی ، گفت که افراد "احتمالاً" طی یک سال از دریافت دو دوز به یک واکسن اضافی نیاز دارند. Pfizer در ژوئن یک آزمایش برای ترکیب یک تقویت کننده با واکسن Prevnar ، برای بیماری پنوموکوک ، آغاز کرد.
مصوب برای استفاده در: بحرین ، برزیل ، نیوزیلند ، عربستان سعودی ، سوئیس.
استفاده اضطراری در: آرژانتین ، استرالیا ، بنگلادش ، برمودا ، بوتسوانا ، برونئی ، کابو ورد NEW ، کانادا ، شیلی ، کلمبیا ، کاستاریکا ، اکوادور ، اتحادیه اروپا ، گرینلند ، گواتمالا ، هنگ کنگ ، ایسلند ، عراق ، اسرائیل ، ژاپن ، اردن ، کویت ، لبنان ، لیبی NEW ، لیختن اشتاین ، مالزی ، مالدیو ، مکزیک ، مولداوی ، موناکو ، مغولستان ، نروژ ، مقدونیه شمالی ، عمان ، پاکستان ، پاناما ، پرو ، فیلیپین ، قطر ، سنت وینسنت و گرنادین های جدید ، صربستان ، سنگاپور ، سریلانکا ، آفریقای جنوبی ، کره جنوبی ، سنت مارتن ، تونس ، ترکیه ، اوکراین ، امارات متحده عربی ، انگلستان ، ایالات متحده ، اروگوئه ، ویتنام NEW. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی. برای استفاده اضطراری توسط سیستم تنظیم مقررات کارائیب توصیه می شود.
استفاده محدود در چین
نام واکسن: Convidecia (همچنین به عنوان Ad5-nCoV شناخته می شود)
کارایی: ناشناخته
دوز: تک دوز
نوع: تزریق عضله
ذخیره سازی: در یخچال
شرکت چینی CanSino Biologics Convidecia را با مشارکت موسسه زیست شناسی در آکادمی علوم پزشکی نظامی این کشور توسعه داد. واکسن تک شات بر اساس آدنوویروسی به نام Ad5 است. در ماه مه گذشته، محققان نتایج امیدوارکنندهای را از یک آزمایش ایمنی فاز 1 روی Convidecia منتشر کردند و در ژوئیه گزارش دادند که آزمایشهای فاز 2 آنها نشان داد که واکسن یک پاسخ ایمنی قوی ایجاد میکند. ارتش چین در اقدامی بیسابقه، این واکسن را در ۲۵ ژوئن به مدت یک سال بهعنوان «داروی مورد نیاز ویژه» تأیید کرد. در 28 نوامبر، مدیر اجرایی CanSino Biologics در مصاحبه ای گفت که حدود 40000 تا 50000 نفر Convidecia دریافت کرده اند.
از آگوست 2020، CanSino اجرای آزمایشی فاز 3 را در تعدادی از کشورها از جمله پاکستان، روسیه، مکزیک و شیلی آغاز کرد. در 25 فوریه 2021، چین تاییدیه واکسن CanSino را برای استفاده عمومی اعلام کرد.
نتایج کارآزمایی فاز 3 که در دسامبر 2021 در The Lancet منتشر شد، نشان داد که Convidecia در برابر کووید-19 اثربخشی 57.5 درصدی دارد. در برابر بیماری شدید، اثربخشی آن 91.7 درصد بود.
با گذشت زمان، مشخص شد که اثربخشی Convidecia در حال کاهش است و محققان شروع به آزمایش تقویت کننده ها کردند. در ژانویه 2022، محققان چینی گزارش دادند که یک تقویت کننده استنشاقی Convidecia در افرادی که در ابتدا واکسن متفاوتی دریافت کرده بودند، بی خطر بود و سطوح بسیار بالایی از آنتی بادی علیه ویروس کرونا تولید کرد.
مصوب برای استفاده در: چین.
استفاده اضطراری در: آرژانتین ، شیلی ، اکوادور جدید ، مجارستان ، مالزی ، مکزیک ، مولداوی ، پاکستان.
نام واکسن: CoronaVac (PiCoVacc سابق)
کارآیی: 50.38٪
دوز: 2 دوز ، با فاصله 2 هفته
نوع: تزریق عضله
ذخیره سازی: در یخچال نگهداری می شود
Sinovac Biotech ، یک شرکت خصوصی چینی ، واکسنی غیرفعال به نام CoronaVac را در اوایل سال 2020 تولید کرد. در اوایل سال 2021 ، آزمایشات در برزیل و ترکیه نشان داد که می تواند در برابر Covid-19 محافظت کند ، اما نتایج بسیار متفاوت - به دلیل طراحی آنها آزمایشات متفاوت است. در برزیل ، اثر در برابر Covid-19 با یا بدون علائم 50 درصد بود. در ترکیه ، اثر در برابر Covid-19 با حداقل یک علامت 25/91 درصد بود. Sinovac برخی از اطلاعات خود را در تاریخ 3 آوریل منتشر کرد ، اما هنوز جزئیات آزمایشات را به عنوان پیش چاپ یا در یک مجله پزشکی منتشر نکرده است. با این وجود ، سینوواک در 6 فوریه اعلام کرد که چین تصویب مشروط CoronaVac را داده است. چین مجوز خود را برای ورود کودکان و نوجوانان در 4 ژوئن گسترش داد. سازمان بهداشت جهانی مجوز اضطراری واکسن را در 1 ژوئن 2021 صادر کرد.
Sinovac پس از ایجاد واکسن خود در بهار گذشته ، آزمایش فاز 1/2 را روی 743 داوطلب انجام داد که هیچ عوارض جانبی جدی را نشان نداد. سینوواک جزئیات دادگاه را در ماه نوامبر در یک ژورنال پزشکی منتشر کرد که تولید نسبتاً کم آنتی بادی را نشان می دهد. در ماه جولای ، سینوواک یک آزمایش فاز 3 را در برزیل و سپس دادگاه های دیگر در اندونزی و ترکیه آغاز کرد.
در همان ماه ، دولت چین برای استفاده محدود ، تصویب اضطراری به CoronaVac داد. در ماه اکتبر ، مقامات در شهر جیاکسینگ در شرق چین اعلام کردند که CoronaVac را به افرادی در مشاغل نسبتاً پرخطر اعم از کارگران پزشکی ، بازرسان بندر و پرسنل خدمات عمومی می دهند.
دانشمندان آزمایشی فاز 3 اعلام نتایج اولیه در پایان دسامبر را آغاز کردند و با بروز موارد جدید Covid-19 آنها را به روز کردند. در حالی که کارآیی کلی واکسن در آزمایش برزیل کمتر بود ، اما محافظت قوی تری در برابر اشکال شدید بیماری نشان داد. هیچ کس در دادگاه برزیل که Sinovac را دریافت کرده مجبور به بستری شدن در بیمارستان نیست. در تاریخ 30 مه 2021 ، محققان برزیلی اعلام کردند هنگامی که این واکسن را به کل شهر می دهند ، میزان بیماری ، بستری شدن و مرگ و میر به طور چشمگیری کاهش یافته است.
Sinovac حداقل 11 کشور و منطقه را برای تهیه SinoVac برای آنها معامله کرده است. اندونزی مجوز واکسن اضطراری را در 11 ژانویه داد و دو روز بعد رئیس جمهور اندونزی از طریق تلویزیون زنده CoronaVac را تزریق کرد. ترکیه این واکسن را در 13 ژانویه مجاز دانست و رئیس جمهور آن روز بعد واکسن زد. برزیل در 17 ژانویه مجوز CoronaVac را صادر کرد. در تاریخ 4 مه ، آژانس دارویی اروپا اعلام کرد که در حال شروع یک بررسی گسترده از CoronaVac است ، که اگر شرکت تصمیم به درخواست یک مجوز بخشد ، سرعت فروش Sinovac را تسریع می کند.
در اول آوریل ، سینووک اعلام کرد که پس از تکمیل خط تولید سوم ، ظرفیت آن به 2 میلیارد دوز افزایش یافته است.
Sinovac در 13 مه آزمایش فاز 2 واکسن را در کودکان و نوجوانان ثبت کرد.
مصوب برای استفاده در: چین.
استفاده اضطراری در: آذربایجان ، بنگلادش ، بوتسوانا ، برزیل ، کامبوج ، شیلی ، کلمبیا ، جمهوری دومنیکن ، اکوادور ، مصر ، هنگ کنگ ، اندونزی ، لائوس ، مالزی ، مکزیک ، مولداوی ، پاکستان ، پاناما ، فیلیپین ، تایلند ، تیمور-لستte جدید ، تونس ، ترکیه ، اوکراین ، اروگوئه ، زیمبابوه. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی.
نام واکسن: BBIBP-CorV
کارایی: 79.34٪
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
سازمان بهداشت جهانی این واکسن را تایید کرده است.
موسسه محصولات بیولوژیکی پکن یک واکسن ویروس کرونا ویروس غیرفعال ایجاد کرد که توسط شرکت دولتی چینی Sinopharm در آزمایشات بالینی قرار گرفت. در تاریخ 30 دسامبر ، سینوفرم اعلام کرد که این واکسن دارای اثر 79.34 درصدی است و این باعث می شود دولت چین آن را تأیید کند. در 7 ماه مه ، سازمان بهداشت جهانی تخمین کارآیی مشابه 78.1 درصد را ارائه داد و مجوز استفاده اضطراری از واکسن را صادر کرد. جزئیات دادگاه فاز 3 هنوز در یک مجله علمی منتشر نشده است.
در ماه ژوئن گذشته ، محققان موسسه پکن گزارش دادند که این واکسن نتایج امیدوار کننده ای در میمون ها به وجود آورد. یک آزمایش فاز 1/2 سپس نشان داد که واکسن هیچ عارضه جانبی جدی ایجاد نکرده و افراد را قادر به ساخت آنتی بادی علیه ویروس کرونا می کند. در ماه جولای ، دادگاه فاز 3 در امارات متحده عربی در ماه ژوئیه و در مراکش و پرو در ماه بعد آغاز شد.
در 14 سپتامبر ، U.A.E. تصویب اضطراری واکسن Sinopharm برای استفاده در مراقبت های بهداشتی را انجام داد و به زودی مقامات دولتی و دیگران نیز آن را دریافت کردند. کمتر از دو ماه بعد ، در 9 دسامبر ، U.A.E. تایید کامل BBIBP-CorV ، اعلام کرد که میزان کارایی آن 86 درصد است. از آن زمان تاکنون تعدادی از کشورهای خاور نزدیک آن را مجاز دانسته اند. در تاریخ 29 ژانویه ، مجارستان BBIBp-CorV را مجاز دانست و این کشور را به عنوان اولین کشور اروپایی استفاده کرد که از واکسن چینی استفاده می کند.
در همین حال ، در چین ، دولت تصویب اضطراری Sinopharm را در تابستان 0 تا 2020 صادر کرد. مقامات دولتی ، کارکنان بهداشت و سایر گروه های منتخب شروع به دریافت BBIIP-CorV کردند. در ماه مه ، چین ادعا کرد که می تواند تا پایان سال 2021 تا 5 میلیارد دوز تولید کند ، اما مقامات چینی هشدار دادند که این کشور در تلاش است تا دوزهای کافی برای جمعیت خود تولید کند.
در فوریه 2021 ، همزمان با افزایش نگرانی در مورد جهش های جدید در ویروس کرونا ، محققان چینی BBIBP-CorV را در برابر نوعی به نام B.1.351 آزمایش کردند که اولین بار در آفریقای جنوبی یافت شد. آنها گزارش دادند که پاسخ آنتی بادی ایجاد شده توسط واکسن در برابر B.1.351 فقط نسبتاً ضعیف است. این مطالعه هنوز در یک مجله پزشکی منتشر نشده است. U.A.E. خلیج امروز در 10 ژوئن گزارش داد که اکنون واکسن را در کودکان آزمایش می کند.
در تاریخ 18 مه ، در میان نگرانی در مورد اثربخشی واکسن ، U.A.E. اعلام کرد که عکسهای تقویت کننده ای را برای کسانی که دو دوز BBIBP-CorV دریافت کرده اند فراهم می کند. بحرین با اعلامیه مشابهی در تاریخ 3 ژوئن دنبال کرد.
در ژانویه 2022، تیمی از دانشمندان از چین و امارات متحده عربی، گزارشی منتشر کردن که نشان میداد این تقویتکننده دوز قویتری از آنتیبادیها علیه نوع Omicron نسبت به دوز سوم واکسن ویروس غیرفعال سینوفارم تولید میکند.
مصوب برای استفاده در: بحرین ، چین ، امارات متحده عربی.
استفاده اضطراری در: آنگولا ، آرژانتین ، بنگلادش ، برونئی ، کامبوج ، مصر ، گابن ، گامبیا جدید ، گویان ، مجارستان ، اندونزی ، ایران ، عراق ، اردن ، لبنان ، مالدیو ، مولداوی ، مغولستان ، مراکش ، نامیبیا ، نپال ، مقدونیه شمالی ، پاکستان ، پرو ، فیلیپین ، سیرالئون ، جزایر سلیمان NEW ، سریلانکا ، تایلند ، ویتنام ، ونزوئلا ، زیمبابوه. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی.
استفاده محدود در چین، امارات محتده عربی
Sinopharm همراه با واکسن انستیتوی پکن خود یک واکسن ویروس غیرفعال را که توسط م Instituteسسه محصولات بیولوژیکی ووهان ساخته شده آزمایش کرد. آزمایش فاز 1/2 نشان داد که این واکسن در افراد داوطلب آنتی بادی تولید می کند ، برخی از آنها تب و سایر عوارض جانبی را تجربه می کنند. Sinopharm گفت: اثر واکسن 72.51 درصد است. نسخه واکسن ووهان در چندین مرحله در حال آزمایش فاز 3 است. در ماه دسامبر ، پرو آزمایش سینوفرم خود را برای بررسی مشکلات عصبی که یک داوطلب تجربه کرده بود ، به طور مختصر متوقف کرد ، اما تشخیص داد که هیچ ارتباطی با واکسن ها ندارد. در تاریخ 25 فوریه ، چین تصویب واکسن ووهان برای استفاده عمومی را اعلام کرد. اثر تعیین شده از آزمایشات فاز 3 هنوز منتشر نشده است.
مصوب برای استفاده در: چین.
استفاده محدود در: امارات متحده عربی.
نام واکسن: کوواکسین (همچنین به عنوان BBV152 A ، B ، C شناخته می شود)
کارایی: ناشناخته
دوز: 2 دوز ، با فاصله 4 هفته
ذخیره سازی: حداقل یک هفته در دمای اتاق
با همکاری شورای تحقیقات پزشکی هند و انستیتوی ملی ویروس شناسی ، شرکت هندی Bharat Biotech واکسن کوواکسین را طراحی کرد که بر اساس نوع غیرفعال ویروس کرونا ساخته شده است. در آوریل 2021 ، این اولین واکسنی بود که در هند مجوز اضطراری گرفت.
ژوئن گذشته ، پس از مطالعات روی میمون ها و همسترها ، مشخص شد که این واکسن از ایمنی در برابر عفونت محافظت می کند ، Covaxin به آزمایشات بالینی پرداخت. آزمایش فاز 1/2 نشان داد که واکسن هنگام تولید آنتی بادی برای ویروس کرونا هیچ عارضه جانبی جدی ایجاد نکرده است. یک مطالعه پیگیری این نتایج را تأیید کرد. در 23 اکتبر ، این شرکت اعلام کرد که آنها در حال آغاز یک آزمایش فاز 3 هستند و در نهایت بیش از 25800 داوطلب را جذب می کنند.
در تاریخ 3 ژانویه ، دولت هند مجوز اضطراری Covaxin را صادر کرد. دو ماه بعد ، این شرکت شروع به انتشار یک سری گزارش ها در مورد آزمایش کرد ، و نتایج نهایی را در تاریخ 2 ژوئیه ارسال کرد. این واکسن دارای اثر 77.8 درصدی در برابر Covid-19 علامت دار بود و اثر آن در برابر Covid-19 شدید 93.4 درصد بود . برای بیماری بدون علامت ، این واکسن 6/63 درصد کارایی داشته است ، که نشان می دهد می تواند انتقال را نیز کند کند. محققان بهارات همچنین نحوه عملکرد واکسن علیه دلتا را مطالعه کردند ، نوعی که در بهار 2021 بر هند غلبه کرد. آزمایش نشان داد که اثر آن در برابر دلتا 65.2 درصد است.
گزارش های قبلی نشان می داد که به طور خاص برای Covid-19 شدید ، Covaxin 100 درصد اثر دارد. این شرکت همچنین دریافت كه واكسن 70 درصد در برابر Covid-19 بدون علائم اثر دارد ، كه نشان می دهد كواكسین می تواند از گسترش ویروس جلوگیری كند. این محاکمه فقط داوطلبان بزرگسال را مورد بررسی قرار داد. در ماه ژوئن ، این شرکت آزمایشی را در مورد کودکان 2 ماهه در ماه ژوئن ثبت کرد.
بهارات انتظار دارد پس از گسترش ظرفیت تولید خود ، سالانه یک میلیارد دوز تولید کند. این شرکت با همکاری Ocugen مستقر در پنسیلوانیا برای توسعه Covaxin برای بازار ایالات متحده همکاری کرد. در ژوئن 2021 ، Ocugen اعلام کرد که به جای مجوز استفاده اضطراری ، به دنبال مجوز کامل برای واکسن هستند.
استفاده اضطراری در: بوتسوانا ، برزیل ، گواتمالا ، گویان ، هند ، ایران ، موریس ، مکزیک ، نپال ، نیکاراگوئه ، پاراگوئه ، فیلیپین ، زیمبابوه.
Updated Aug. 4نام واکسن: mRNA-1273
کارایی: 94.5٪
دوز: 2 دوز ، با فاصله 4 هفته
نوع: تزریق عضله
ذخیره سازی: 30 روز با یخچال ، 6 ماه در –4 درجه فارنهایت (–20 درجه سانتیگراد)
سازمان بهداشت جهانی این واکسن را تایید کرده است.
در 18 دسامبر ، F.D.A. مجوز استفاده اضطراری برای واکسن ساخته شده توسط شرکت مدرنا مستقر در بوستون را داد. واکسن Moderna دومین واکسن مجاز توسط F.D.A است که یک هفته پس از واکسن ساخته شده توسط Pfizer و BioNTech وارد می شود. در تاریخ 1 ژوئن 2021 ، مدرنا اعلام کرد که به دنبال مجوز کامل برای واکسن خود است.
مانند Pfizer و BioNTech ، Moderna واکسن خود را از mRNA تهیه می کند. در سال های اخیر ، این شرکت واکسن mRNA را برای تعدادی بیماری آزمایش کرده است ، اما هنوز واکسن های آن را به بازار عرضه نکرده اند. در ژانویه گذشته ، آنها شروع به تولید واکسن برای ویروس کرونا کردند.
دولت ایالات متحده تلاشهای Moderna را با پشتیبانی تقریباً 1 میلیارد دلاری با حساب مالی ارائه كرد. آنها با همکاری موسسه ملی بهداشت دریافتند که این واکسن از میمون ها در برابر ویروس کرونا محافظت می کند. مارس گذشته ، دانشمندان اولین کسی بودند که واکسن Covid-19 را در آزمایشات انسانی قرار دادند. پس از آنکه نتایج این مطالعات امیدوار کننده بود ، آزمایش مرحله 3 روی 30،000 داوطلب از 27 جولای آغاز شد.
در 16 نوامبر ، Moderna اولین داده های مقدماتی آزمایش را اعلام کرد و به دنبال آن اطلاعات کامل در 30 نوامبر منتشر شد. محققان تخمین زدند که میزان واکسن 94.1 درصد است. گرچه مشخص نیست این اثر چقدر دوام خواهد داشت ، Moderna دریافت که بعد از سه ماه شرکت کنندگان در آزمایش همچنان از یک دفاع ایمنی قوی در برابر ویروس کرونا استفاده می کنند. در تاریخ 25 مه 2021 ، مدرنا اعلام کرد که این واکسن با اطمینان از کودکان 12 ساله محافظت قوی می کند. این شرکت در حال آزمایش واکسن در نوزادان و کودکان خردسال است.
در همین حال ، این شرکت برای تأمین واکسن تا زمان تأیید با چندین کشور وارد معاملات شد. در 11 آگوست سال گذشته ، در صورت اثبات ایمنی و موثر بودن واکسن ، دولت ایالات متحده 1.5 میلیارد دلار در ازای 100 میلیون دوز اضافی به این شرکت اعطا کرد. مذاکرات اضافی توافق را به 500 میلیون دوز افزایش داده است. کمیسیون اروپا 460 میلیون دوز را تأمین کرده است. Moderna معاملات مشابهی را با کشورهای دیگر از جمله کانادا ، ژاپن ، قطر و کره جنوبی انجام داده است. Moderna همچنین متعهد شده است 500 میلیون دوز به COVAX ، یک ابتکار جهانی واکسن ، برای تأمین واکسن به کشورهای کم درآمد بدهد. در 29 آوریل ، مدرنا اعلام کرد که 800 میلیون تا 1 میلیارد دوز در سال 2021 تولید می کند و قصد دارد 3 میلیارد دوز در سال 2022 تولید کند.
آزمایش های انجام شده بر روی واکسن Moderna نشان می دهد که این ماده محافظت شدیدی در برابر انواع غالب مانند بتا و دلتا ایجاد می کند. در ماه مارس ، Moderna آزمایش فاز 1 واکسن mRNA جدیدی را که به طور خاص برای نوع بتا ساخته شده بود ، آغاز کرد. یک نوع تقویت کننده خاص واکسن Moderna نتایج مثبتی را در انسان و موش به همراه داشته است. همچنین در حال انجام آزمایش فاز 1 واکسن جدید و پایدار در یخچال است. واکسن Moderna’s یکی از چندین واکسنی است که در مطالعه آکسفورد مورد آزمایش قرار گرفته و اندازه گیری می کند که دوزهای متناوب چگونه می توانند ایمنی بدن را تقویت کنند. N.I.H. یک آزمایش بالینی را برای ارزیابی واکسن Moderna's به عنوان یک تقویت کننده آغاز کرده است.
مصوب برای استفاده در: سوئیس.
استفاده اضطراری در: بوتسوانا ، کانادا ، اتحادیه اروپا ، گرینلند ، گواتمالا ، هندوراس ، ایسلند ، اسرائیل ، ژاپن ، کویت ، لیبی جدید ، مالدیو ، مولداوی ، مغولستان ، نروژ ، فیلیپین ، قطر ، سنت وینسنت و گرنادین های جدید ، سنگاپور ، جنوب کره ، تایوان ، تایلند ، انگلستان ، ایالات متحده ، ویتنام. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی.
مرکز چوماکوف در آکادمی علوم روسیه یک واکسن ویروس کرونا ویروس غیرفعال به نام CoviVac تولید کرد. در 14 اکتبر ، تاس گزارش داد که آزمایشات بالینی واکسن از 19 مهر در Kirov و سن پترزبورگ آغاز می شود. در 20 فوریه ، روسیه این واکسن را برای مصارف خانگی تصویب کرد ، علی رغم این واقعیت که مرکز چوماکوف بعداً شروع به کار کرد آزمایش فاز 3 در تاریخ 3 ژوئن ، مدیر مرکز چوماکوف گفت که آزمایش هنوز در جریان است و هنوز نمی توان در مورد اثر واکسن صحبت کرد.
این کارگردان در 24 اوت گفت که مرکز چوماکوف در حال کار بر روی نسخه اصلاح شده واکسن است که برای انواع جدید طراحی شده است و آنها قصد دارند ظرفیت تولید CoviVac را دو برابر کنند و به 2.5 میلیون دوز در ماه برسانند. او بعداً گفت که مرکز چوماکوف میتواند 20 میلیون دوز در سال 2022 تولید کند. مدیر در اکتبر به تاس گفت که آزمایشی برای بزرگسالان 60 سال و بالاتر میتواند به زودی آغاز شود. در 18 نوامبر، تاس گزارش داد که چوماکوف همچنین در حال توسعه دو واکسن بر اساس سویه دلتا است. Chumakov تاییدیه شروع آزمایشات فاز 3 در کودکان را در 7 فوریه 2022 دریافت کرد. به گفته مدیر مرکز Chumakov، CoviVac حدود 62 درصد در برابر نوع Omicron موثر است.
استفاده زودهنگام در: روسیه.
Updated Feb. 8نام واکسن: AZD1222 (در هند با نام Covishield نیز شناخته می شود)
کارایی: بسته به مقدار مصرف ، 62 تا 90 درصد است
دوز: 2 دوز ، با فاصله 4 هفته
نوع: تزریق عضله
محل نگهداری: حداقل 6 ماه در یخچال ثابت است
سازمان بهداشت جهانی این واکسن را تایید کرده است.
واکسنی که توسط دانشگاه آکسفورد طراحی شده و توسط شرکت انگلیسی-سوئدی AstraZeneca تولید شده است به عنوان یک عنصر اصلی در تلاش برای تأمین تقاضای جهانی واکسن Covid-19 ظاهر شده است. با کارآیی 76 درصدی ، واکسن - که اکنون با نام Vaxzevria شناخته می شود - در مقادیر گسترده و با قیمت پایین تولید می شود. از آنجا که فقط به جای یخ زدگی باید در یخچال نگهداری شود ، می توان بسیار گسترده تر از واکسن های mRNA استفاده کرد. اما سفر Vaxzevria ناآرام بوده است ، و پیام های گیج کننده AstraZeneca ، نگرانی های برجسته در مورد ایمنی و مشکلات تولید را به لرزه در آورده است.
در اوایل سال 2020 ، محققان آکسفورد این واکسن را با مهندسی ژنتیک یک آدنو ویروس که به طور معمول شامپانزه ها را آلوده می کند ، تولید کردند. هنگامی که آنها واکسن را به میمون ها دادند ، دریافتند که از حیوانات در برابر بیماری محافظت می کند.
آنها که با AstraZeneca سر و کار داشتند ، آنها با یک آزمایش فاز 1/2 پیگیری کردند. تولید کنندگان واکسن در آزمایش هیچ عارضه جانبی شدیدی را مشاهده نکردند ، در حالی که مشاهده کردند واکسن باعث افزایش آنتی بادی علیه ویروس کرونا و همچنین سایر سیستم های دفاعی ایمنی می شود. AstraZeneca و آکسفورد سپس در انگلستان ، آفریقای جنوبی و جاهای دیگر مراحل آزمایشی را آغاز کردند. اما محققان این آزمایشات را به طور مستقل انجام دادند ، بنابراین ترکیب نتایج آنها در یک تصویر واضح و واضح از چگونگی عملکرد واکسن دشوار است. بدتر از همه ، آنها مقادیر مختلفی از واکسن را به افراد مختلف دادند و همچنین چهار یا دوازده هفته منتظر ماندند تا دوز دوم را تحویل دهند.
در 8 دسامبر ، AstraZeneca و آکسفورد اولین مقاله علمی را در مورد آزمایش بالینی فاز 3 واکسن ویروس کرونا منتشر کردند. این آزمایش نشان داد که این واکسن می تواند از افراد در برابر Covid-19 محافظت کند ، اما بسیاری از س questionsالات در مورد نتایج حل نشده باقی مانده است. با این وجود ، کم هزینه بودن و سهولت ذخیره سازی واکسن ، آن را برای کشورهایی که به دنبال راهی برای خروج از بیماری همه گیر هستند ، جذاب کرده است. انگلستان و آرژانتین اولین کشورهایی بودند که در 30 دسامبر مجوز واکسن را برای موارد اضطراری صادر کردند. در 3 ژانویه ، هند نسخه ای به نام Covishield را که توسط م Instituteسسه سرم هند ساخته شده است ، تصویب کرد. در 16 فوریه سازمان بهداشت جهانی واکسن را برای استفاده اضطراری در بزرگسالان 18 سال یا بالاتر توصیه کرد. برزیل در 13 مارس این واکسن را تأیید کامل کرد. در همان ماه ، کوواکس تحویل میلیون ها دوز واکسن را به کشورهای با درآمد کم و متوسط آغاز کرد. این شرکت انتظار می رود ظرفیت تولید سالانه دو میلیارد دوز باشد.
با این وجود حتی پس از اینکه میلیون ها نفر واکسن را دریافت کردند ، نگرانی های جدیدی ایجاد شد. در آفریقای جنوبی ، یک محاکمه کوچک نتوانست نشان دهد که مردم را در برابر نوع B.1.351 ، که در این کشور غالب شده است ، محافظت می کند. در 7 فوریه ، آفریقای جنوبی برنامه تولید 1 میلیون دوز واکسن AstraZeneca را متوقف کرد.
در مارس 2021 ، نگرانی دیگری پدیدار شد. تنظیم کننده های پزشکی اروپا نگران تعداد اندکی از موارد لخته شدن خون در افراد جوانی که واکسزوریا را دریافت کرده اند شدند. آژانس دارویی اروپا به این نتیجه رسید که این واکسن یک عارضه جانبی بسیار نادر دارد که در آن افراد دچار لخته شدن خون در رگهای بزرگ همراه با پلاکت کم می شوند. نهادهای نظارتی تأکید کردند که واکسن م effectiveثر است و فواید آن بیشتر از خطر ناچیز عوارض آن است. در پاسخ برخی از کشورها تصمیم گرفتند با محدود کردن واکسن به افراد مسن ، خطر را به حداقل برسانند. در ماه مه ، نروژ Vaxzevria را به طور دائم از برنامه واکسیناسیون خود حذف کرد.
با وجود حمایت جنجالی که از توسعه آن ارائه شده ، ایالات متحده هنوز مجوز واکسزوریا را نداده است. در سال 2020 ، دولت یک میلیارد دلار به AstraZeneca برای پرداخت تحقیقات ، آزمایشات بالینی و تولید کمک کرد. در آن تابستان ، این شرکت قول داد که به زودی در ماه اکتبر Vaxzevria را در ایالات متحده توزیع کند. اما نگرانی در مورد سلامت یک داوطلب در کارآزمایی بالینی ایالات متحده ، مطالعه را به مدت هفت هفته متوقف کرد. AstraZeneca نتایج دادگاه را تا مارس 2021 تحویل نداد - فقط توسط مشاوران متخصص خود برای داده های برداشت گیلاس سرزنش شد. دو روز بعد ، این شرکت اعلام کرد که بررسی کامل آزمایشات نشان داد که این واکسن 76 درصد در برابر Covid-19 و 100 درصد در برابر بیماری شدید و بستری شدن در بیمارستان اثر دارد. AstraZeneca در حال آماده سازی برنامه خود برای F.D.A. برای مجوز کامل
AstraZeneca حتی در حالی که در حال انجام آزمایشات بالینی بود ، برای تولید میلیاردها دوز Vaxzevria با تعدادی از تولیدکنندگان به توافق رسید. اما در ژانویه 2021 ، آن اعتراف کرد که از تحویل واکسن های وعده داده شده به اتحادیه اروپا بازمانده است. کمبود آن در مارس زمانی بدتر شد که هند ، با انفجار موارد جدید ، مانع از صادرات واکسن از کارخانه های خود شد. در تاریخ 26 آوریل ، کمیسیون اروپا شکایتی علیه این شرکت به دلیل نقض قرارداد ارائه داد. دادگاه در 18 ژوئن به AstraZeneca دستور داد 50 میلیون دوز اضافی Vaxzevria تحویل دهد ، كه كمتر از 90 میلیون كمیسیون اروپا بود.
در بهار ، در حالی که سایر کشورها با موج های جدید ویرانگر Covid-19 دست و پنجه نرم می کردند ، ایالات متحده تحت انتقاد شدید برای جلوگیری از مواد اولیه هند مورد نیاز هند برای تهیه کوویشیلد خود قرار گرفت. در تاریخ 25 آوریل ، دولت بایدن اعلام کرد که ممنوعیت خود را تا حدی لغو خواهد کرد. اما منتقدان همچنین به انبار میلیون ها دوز واکسن AstraZeneca اشاره دارند که ایالات متحده سال گذشته شروع به ساخت آن کرده است. اکنون که ایالات متحده به اندازه کافی واکسن از شرکت های دیگر گرفته است تا بتواند از همه شهروندان خود محافظت کند ، تماس هایی برای ارسال واکسن AstraZeneca به هند و سایر کشورهایی که نیاز مبرم دارند وجود دارد. در تاریخ 25 آوریل ، دکتر آنتونی فاوسی گفت که دولت ایالات متحده در حال بررسی ارسال واکسن ها است. اما در اواخر ماه ژوئن ، واکسن ها هنوز آزاد نشده بودند.
در همین حال ، AstraZeneca و آکسفورد تحقیقات در مورد واکسن را ادامه می دهند. در 14 فوریه ، آنها اعلام کردند که آزمایشات مربوط به کودکان 6 ساله را آغاز می کنند. در ماه ژوئن ، محققان آکسفورد گزارش دادند که سومین تقویت کننده واکسن AstraZeneca پاسخ های ایمنی شدیدی را در داوطلبان ایجاد می کند. در یک مطالعه جداگانه ، تیم دیگری از
در مارس 2021، کوواکس شروع به تحویل دوزهای واکسن به کشورهای با درآمد کم و متوسط کرد. اما گلوگاه های تولید باعث کندی خط لوله شده است. رویترز در 8 دسامبر گزارش داد که کاهش تقاضا برای این واکسن باعث شده است که موسسه سرم هند تولید واکسن های جدید Vaxzevria را به نصف کاهش دهد.
VARIANTSA مطالعه بریتانیایی نشان داد که واکسن AstraZeneca 67 درصد در برابر عفونت با واریانت دلتا مؤثر است. یک مطالعه کانادایی نشان داد که اثربخشی آن 87 درصد در برابر بستری شدن در بیمارستان و مرگ ناشی از آن بود.
AstraZeneca و آکسفورد روی نسخه جدیدی از واکسن متناسب با نوع بتا کار کردند و در حال آزمایش نسخه ای هستند که می تواند به عنوان اسپری بینی تحویل داده شود. در 28 ژوئن 2021، شرکت کنندگان دوزهایی از واکسن نوع بتا به نام AZD2816 را در فاز 2/3 آزمایشی جدید دریافت کردند. اما در 10 فوریه 2022، AstraZeneca اعلام کرد که پیشرفت در زمینه واکسن را کنار گذاشته است، زیرا این واکسن تفاوت معنی داری در اثربخشی در برابر انواع مختلف در مقایسه با Vaxzevria ایجاد نکرد.
در ژوئن، محققان آکسفورد گزارش دادند که سومین تقویت کننده واکسن AstraZeneca باعث ایجاد پاسخ های ایمنی قوی در داوطلبان شد. در 3 دسامبر، بلومبرگ گزارش داد که AstraZeneca در حال کنار گذاشتن برنامه های خود برای آزمایش تقویت کننده در ایالات متحده است و شرکت کنندگان در آزمایش را تشویق کرد تا برای واکسن سوم خود به دنبال واکسنی متفاوت باشند.
عوارض جانبی در مارس 2021، تنظیم کننده های پزشکی اروپایی در مورد تعداد کمی از موارد لخته شدن خون در افراد جوانی که واکسوریا دریافت کرده بودند، نگران شدند. آژانس دارویی اروپا به این نتیجه رسید که این واکسن یک عارضه جانبی بسیار نادر دارد که در آن افراد دچار لخته شدن خون در رگهای بزرگ همراه با پلاکت کم می شوند. رگولاتورها تاکید کردند که واکسن موثر است و فوایدی که ارائه می کند بر خطر اندک عوارض جانبی آن بیشتر است. در پاسخ، برخی کشورها تصمیم گرفتند با محدود کردن واکسن برای افراد مسن، خطر را به حداقل برسانند. در ماه مه، نروژ Vaxzevria را برای همیشه از برنامه واکسیناسیون خود حذف کرد. در ماه اوت، تیمی از محققان بریتانیایی گزارش دادند که خطر لخته شدن خون در اثر کووید-19 بسیار بیشتر از واکسن Vaxzevria است.
مصوب برای استفاده در: برزیل.
استفاده متوقف شده در: دانمارک ، نروژ.
استفاده اضطراری در: الجزایر ، آنگولا ، آنتیگوا ، آرژانتین ، استرالیا ، باهاما ، بحرین ، بنگلادش ، باربادوس ، برمودا ، بوتان ، بوتسوانا ، برزیل ، برونئی ، کابو ورد جدید ، کامبوج ، کانادا ، شیلی ، کلمبیا ، کاستاریکا ، قبرس ، دومنیکن جمهوری ، اکوادور ، مصر ، السالوادور ، اتیوپی ، اتحادیه اروپا ، فیجی ، جورجیا ، غنا ، گرینلند ، گواتمالا ، هائیتی ، هندوراس ، مجارستان ، ایسلند ، هند ، اندونزی ، ایران ، عراق ، جامائیکا ، ژاپن ، کنیا ، کویت ، لبنان ، لیبی جدید ، لیختن اشتاین ، مالزی ، مالدیو ، مکزیک ، مولداوی ، مغولستان ، مراکش ، نامیبیا ، نپال ، نیجریه ، مقدونیه شمالی ، نروژ ، پاکستان ، پاناما ، پاپوآ گینه نو ، پرو ، فیلیپین ، رواندا ، عربستان سعودی ، صربستان ، سیشل ، سیرا لئون ، جزایر سلیمان ، آفریقای جنوبی ، کره جنوبی ، سریلانکا ، سنت وینسنت و گرنادین های جدید ، سنت کیتس و نویس ، سودان ، تایوان ، تایلند ، تیمور لست ، اوگاندا ، اوکراین ، انگلستان ، وانواتو NEW ، ویتنام ، زامبیا . اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی. تایید شده توسط گروه تنظیم مقررات آفریقا. برای استفاده اضطراری توسط سیستم تنظیم مقررات کارائیب توصیه می شود.
نام واکسن: Sputnik V (معروف به Gam-Covid-Vac)
کارایی: 91.4٪
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
ذخیره سازی: ذخیره سازی فریزر. در حال توسعه یک فرمولاسیون جایگزین که می تواند در یخچال نگهداری شود.
موسسه تحقیقاتی گامالیا ، بخشی از وزارت بهداشت روسیه ، واکسنی با میزان کارایی 91.6 درصد ایجاد کرده است. سازندگان واکسن نتایج آزمایش فاز 3 خود را در تاریخ 2 فوریه در Lancet منتشر کردند.
Gamaleya این واکسن را که در ابتدا Gam-Covid-Vac نامیده می شد ، از ترکیب دو ویروس آدنو ویروس به نام های Ad5 و Ad26 تولید کرد. چندین سال به عنوان واکسن آزمایش شده است. با ترکیب آنها ، محققان روسی امیدوار بودند که از شرایطی که در آن سیستم ایمنی بدن می تواند واکسن را به عنوان یک جسم خارجی که باید از بین برود ، استفاده کند ، جلوگیری کند. محققان آزمایش های بالینی را در ماه ژوئن آغاز کردند.
در پایان تابستان ، دادگاه درگیر جنجال شد. در 11 آگوست ، رئیس جمهور ولادیمیر ولادین پوتین اعلام کرد که یک تنظیم کننده مراقبت های بهداشتی روسیه واکسن را تأیید کرده است که به Sputnik V. تغییر نام داده است. با این حال آزمایشات فاز 3 حتی آغاز نشده است. متخصصان واکسن این اقدام را خطرناک دانستند و بعداً روسیه اعلامیه را پس گرفت و گفت که تصویب "گواهی ثبت نام مشروط" است ، که به نتایج مثبت آزمایشات فاز 3 بستگی دارد. علاوه بر روسیه ، داوطلبان این محاکمه در بلاروس ، امارات متحده عربی و ونزوئلا نیز استخدام شدند. در 17 اکتبر ، یک آزمایش فاز 2/3 در هند آغاز شد.
در 4 سپتامبر ، سه هفته پس از اعلام پوتین ، محققان گامالیا نتایج آزمایش 1/2 فاز خود را منتشر کردند. آنها دریافتند که Sputnik V آنتی بادی هایی را برای ویروس کرونا ایجاد می کند و عوارض جانبی خفیفی دارد. در 11 نوامبر ، صندوق سرمایه گذاری مستقیم روسیه اولین شواهد اولیه از آزمایش فاز 3 خود را مبنی بر موثر بودن واکسن اعلام کرد. دانشمندان روسی بر اساس 20 مورد Covid-19 در میان شرکت کنندگان در آزمایش ، تخمین زدند که این واکسن 92 درصد کارایی را نشان می دهد.
در ماه دسامبر ، دادگاه در مجموع 78 پرونده به پایان رسید. جزئیات کامل این آزمایش در ماه فوریه منتشر شد ، که نشان دهنده اثربخشی بالا پس از دو دوز است. این آزمایش عوارض جانبی جدی را کشف نکرد. هیچ کس که واکسن زده است مورد جدی Covid-19 را تجربه نکرده است. هنوز ، در 8 ژوئن ، معاون وزیر بهداشت روسیه اولگ گریدنف گفت که کسانی که با اسپوتنیک V واکسینه شده اند ممکن است در آینده نیاز به تزریق واکسن متفاوت داشته باشند.
این آزمایش نشان نداد که Sputnik V به خوبی می تواند انواع جدید ویروس کرونا را مسدود کند. در تحقیقی که در ماه آوریل به صورت آنلاین ارسال شد ، محققان آنتی بادی های افرادی را که این واکسن را دریافت کرده اند بررسی کردند. آنها دریافتند که آنتی بادی های Sputnik V اغلب قادر به خنثی سازی ویروس کرونا نیستند ، و به این ترتیب سلول ها را آلوده می کند.
در اقدامی بی سابقه در زمینه واکسن ویروس کرونا ، موسسه Gamaleya در دسامبر سال 2020 با داروساز AstraZeneca ، که واکسن را بر اساس آدنو ویروس شامپانزه تولید می کند ، پیوست. این دو تیم واکسن های خود را با هم ترکیب کردند تا ببینند آیا این مخلوط می تواند اثر واکسن AstraZeneca را افزایش دهد. دادگاه در فوریه آغاز شد.
در نوامبر سال 2020 ، دولت روسیه پیشنهاد اسپوتنیک V را در داخل روسیه در یک کمپین واکسیناسیون گسترده آغاز کرد. اما نگران بودن این که واکسن به سرعت تصویب شده است ، منجر به تردید گسترده ای شد. در 22 دسامبر ، بلاروس اولین کشوری در خارج از روسیه بود که Sputnik V را ثبت کرد و از آن زمان تعداد دیگری از کشورها نیز این الگو را دنبال کردند. در اروپا ، جایی که انتشار واکسن به شدت متزلزل شد ، ناظران نظارتی Sputnik V را از 4 مارس آغاز کردند. اگر آژانس دارویی اروپا آن را تأیید کند ، بسیاری از کشورهای اروپایی ممکن است این واکسن را استفاده کنند.
در ماه آوریل ، تنظیم کننده واکسن برزیل Sputnik V را رد کرد ، بر اساس تعدادی از نگرانی ها ، از جمله احتمال اینکه ویروس های آدنو موجود در واکسن ها به درستی غیرفعال نشده باشند. پس از هفته ها درگیری پر تنش ، برزیل در ماه ژوئن چراغ سبز به Sputnk V داد ، اما با برخی شرایط - از جمله محدود کردن آن فقط به بزرگسالان سالم. نگرانی در مورد اثر بخشی واکسن نیز هند را وادار کرده است تا مجوز انجام آزمایشات فاز 3 را در این کشور رد کند.
در ژانویه 2021 ، محققان Gamaleya آزمایشی را آغاز کردند که در آن فقط دوز اول آدنو ویروس های Ad26 ، همان آدنو ویروس موجود در واکسن تک دوز جانسون و جانسون ، را به مردم دادند. آنها این نسخه یک دوز را "Sputnik Light" لقب دادند. در 12 فوریه ، مدیر مرکز Gameleya در یک مصاحبه تلویزیونی گفت که احتمالاً فقط چهار تا پنج ماه محافظت می کند. روسیه در تاریخ 6 مه اعلام کرد که اسپوتنیک لایت اثربخشی 79.4 درصدی را ارائه می دهد اما جزئیات مطالعه را منتشر نمی کند و نمی گوید که این دوام چه مدت طول می کشد. Sputnik Light در 6 ماه مه مجوز استفاده در روسیه را دریافت کرد.
در اروپا، تنظیمکنندهها در تاریخ 4 مارس، بازنگری سریع Sputnik V را آغاز کردند. اگر آژانس دارویی اروپا آن را تأیید کند، بسیاری از کشورهای اروپایی ممکن است این واکسن را مصرف کنند. اما بررسی آنها بسیار بیشتر از حد انتظار طول کشیده است، بنا بر گزارش ها به دلیل نگرانی در مورد ساخت اسپوتنیک V.
در ماه آوریل، تنظیم کننده واکسن برزیل اسپوتنیک V را بر اساس تعدادی از نگرانی ها رد کرد، از جمله احتمال اینکه آدنوویروس های موجود در واکسن ها به درستی غیرفعال نشده باشند. پس از هفتهها تقابل پرتنش، برزیل در ماه ژوئن به اسپوتنک V چراغ سبز نشان داد، اما با برخی شرایط - از جمله محدود کردن آن به بزرگسالان سالم. نگرانیها در مورد اثربخشی واکسن، هند را مجبور کرده است تا اجازه انجام آزمایشهای فاز 3 در این کشور را رد کند.
VARIANTSA
مطالعه منتشر شده در جولای نشان داد که آنتیبادیهای اسپوتنیک میتوانند نوع دلتا را خنثی کنند، اگرچه نه به اندازهای که در برابر نسخه اصلی ویروس کار میکردند. موسسه Gamaleya در 13 اکتبر اعلام کرد که اسپوتنیک لایت 70 درصد در برابر نوع دلتا کارایی دارد، اگرچه این مطالعه هنوز در یک مجله علمی منتشر نشده است. تاس در 18 ژانویه 2022 گزارش داد که مدیر موسسه Gamelaya گفت که اسپوتنیک V حدود 75 درصد اثربخشی را در برابر نوع Omicron نشان می دهد، اما این داده ها هنوز در یک مجله معتبر منتشر نشده است.
استفاده اضطراری در: آلبانی ، الجزایر ، آنگولا ، آنتیگوا و باربودا ، آرژانتین ، ارمنستان ، آذربایجان ، بحرین ، بنگلادش ، بلاروس (از جمله Sputnik Light) ، بولیوی ، جمهوری صرب بوسنی ، کامرون ، جمهوری کنگو (از جمله Sputnik Light) ، جیبوتی ، اکوادور ، مصر ، هندوراس ، گابن ، غنا ، گواتمالا ، گینه ، گویان ، مجارستان ، هند ، ایران ، عراق ، اردن ، قزاقستان ، کنیا ، قرقیزستان ، لائوس ، لبنان ، مالدیو ، مالی ، موریس (از جمله Sputnik Light) ، مکزیک ، مولداوی ، مغولستان (شامل Sputnik Light) ، مونته نگرو ، مراکش ، میانمار ، نامیبیا ، نپال ، نیکاراگوئه (از جمله Sputnik Light) ، مقدونیه شمالی ، پاکستان ، تشکیلات خودگردان فلسطین (از جمله Sputnik Light) ، پاناما ، پاراگوئه ، فیلیپین ، روسیه (از جمله Sputnik Light) ، سان مارینو ، صربستان ، سیشل ، اسلواکی ، سریلانکا ، سنت وینسنت و گرنادین ها ، سوریه ، تونس ، ترکیه ، ترکمنستان ، امارات متحده عربی ، ازبکستان ، ونزوئلا (از جمله Sputnik Light) ، ویتنام ، زیمبابوه.
Updated Feb. 15
نام واکسن: Ad26.COV2.S
کارایی: ناشناخته
دوز: 1 دوز
نوع: تزریق عضله
ذخیره سازی: حداکثر دو سال در دمای 4- درجه فارنهایت (20- درجه سانتیگراد) منجمد می شود و تا سه ماه در 36-46 درجه فارنهایت (2-8 درجه سانتیگراد) در یخچال نگهداری می شود.
در 27 فوریه ، F.D.A. مجوز استفاده اضطراری برای واکسن Johnson & Johnson’s را صادر کرد ، و آن را به سومین واکسن ویروس کرونا در ایالات متحده تبدیل کرد. همچنین اولین بار بود که فقط با یک دوز به جای دو نوبت ، ایمن و موثر بود.
کاری که منجر به واکسن شد یک دهه پیش در مرکز پزشکی Beth Israel Deaconess در بوستون آغاز شد ، جایی که محققان روشی را برای ساخت واکسن از ویروسی به نام Adenovirus 26 یا به اختصار Ad26 ایجاد کردند. جانسون و جانسون از Ad26 برای تولید واکسن های ابولا و سایر بیماری ها با Ad26 استفاده کردند. در ژانویه گذشته ، این شرکت و محققان بت اسرائیل برای ایجاد واکسن ویروس کرونا همکاری کردند. مارس گذشته آنها 456 میلیون دلار از دولت ایالات متحده دریافت كردند تا از روند خود به سمت تولید حمایت كنند. پس از اینکه واکسن در آزمایشات روی میمون ها محافظت کرد ، جانسون و جانسون آزمایشات فاز 1/2 را در ماه جولای آغاز کردند.
براساس نتایج امیدوار کننده در این مطالعات ، جانسون و جانسون یک آزمایش فاز 3 را در ماه سپتامبر با استفاده از فقط یک دوز به جای دو مورد آغاز کردند. اگرچه جانسون و جانسون در ابتدا قصد داشتند 60،000 داوطلب را به خدمت بگیرند ، اما با افزایش پرونده ها ، دادگاه در 45،000 در ماه دسامبر پایان داد.
در تاریخ 29 ژانویه ، جانسون و جانسون اعلام کردند که آزمایش ثابت کرده است که واکسن ایمن و م effectiveثر است. در 24 فوریه ، F.D.A. تجزیه و تحلیل خود را از این آزمایش منتشر کردند و نتیجه گرفتند که این واکسن در ایالات متحده 72 درصد ، در آفریقای جنوبی 64 درصد و در آمریکای لاتین 61 درصد کارایی دارد. روز بعد ، بحرین اولین کشوری بود که واکسن را برای استفاده اضطراری مجاز اعلام کرد. دو روز بعد ، ایالات متحده نیز این کار را انجام داد.
بحرین اولین کشوری بود که واکسن را برای استفاده اضطراری در 25 فوریه مجاز کرد. دو روز بعد ، ایالات متحده این کار را دنبال کرد. آفریقای جنوبی بعد از اینکه یک آزمایش کوچک نشان نداد که این ماده در برابر نوع Beta که در سراسر کشور مسلط شده بود ، از استفاده از واکسن AstraZeneca برای کارکنان مراقبت های بهداشتی خود چشم پوشی کرد. آنها به جای آن از Johnson & Johnson استفاده کردند.
در آگوست سال 2020 ، دولت فدرال موافقت كرد كه در صورت تأييد واكسن ، 1 ميليارد دلار به جانسون و جانسون براي 100 ميليون دوز بپردازد. قرار بود بیشتر عرضه ایالات متحده توسط شرکت های راه حل Emergent مستقر در بالتیمور انجام شود. اما این شرکت برای راه اندازی و تولید پیچیده واکسن تلاش کرد. در آوریل 2021 ، F.D.A. یک گزارش تند درباره استانداردهای ملایم شرکت صادر کرد. حداقل 15 میلیون دوز واکسن جانسون و جانسون در کارخانه آلوده شده است. در نتیجه ، این شرکت پس از مجوز فقط 4 میلیون دوز به ایالات متحده تحویل داد و آنها را از کارخانه خود در هلند حمل کرد.
در 13 آوریل ، دولت ایالات متحده در هنگام بررسی گزارشات لخته شدن خون نادر ، مکث در استفاده از واکسن را توصیه کرد. ده روز بعد ، C.D.C. محققان 15 مورد از لخته های غیرمعمول را در نزدیک به 8 میلیون نفر از واکسن دریافت کردند. دولت تصمیم گرفت مکث را برداشته و به واکسن اخطار دهد که زنان جوان ممکن است کمی خطر عوارض جانبی جدی را داشته باشند. در جلسه 12 ماه مه ، C.D.C. محققان در مجموع 28 مورد لخته شدن خون را در بیش از 9 میلیون واکسیناسیون گزارش کردند. در میان زنان بین 30 تا 39 سال ، این میزان 12.4 مورد در هر میلیون دوز است. در زنان بین 40 تا 49 سال ، این میزان 9.4 مورد در هر میلیون دوز است. در میان زنان مسن و مردان در هر سنی ، کمتر از 3 مورد در هر میلیون دوز وجود دارد.
قرارداد جانسون و جانسون خواستار آن بود که 100 میلیون دوز را تا ژوئن 2021 تحویل دهد ، اما مشکلات مداوم آن در تاسیسات بالتیمور احتمال رسیدن آنها به هدف را بعید کرد. در 11 ژوئن ، نیویورک تایمز گزارش داد که F.D.A. به این شرکت گفت که 60 میلیون دوز را بیرون بیندازد. در تاریخ 2 مارس ، مرک اعلام کرد که در ساخت واکسن به جانسون و جانسون کمک خواهد کرد ، اما تولید سریع آن چند ماه طول خواهد کشید.
اتحادیه اروپا در 8 اکتبر 2020 برای 200 میلیون دوز به توافق مشابهی دست یافت. اما پس از ظهور نگرانی در مورد لخته شدن خون نادر ، گزارش هایی منتشر شد که E.U. ممکن است قرارداد خود را با شرکت تمدید نکند. در همین حال ، در تاریخ 29 مارس ، ائتلافی از کشورهای آفریقایی اعلام کرد که تا 40020 دوز واکسن جانسون و جانسون را تا سال 2022 ایمن کرده است. حمل و نقل می تواند به محض سه ماهه سوم سال 2021 آغاز شود. COVAX ، یک همکاری بین المللی برای تحویل واکسن به طور عادلانه در سراسر جهان ، 500 میلیون دوز را تأمین می کند. هدف این شرکت تولید یک میلیارد دوز در سال 2021 است.
در 16 نوامبر سال 2020 ، جانسون و جانسون اعلام کردند که آنها در حال شروع آزمایش دوم فاز 3 برای مشاهده اثرات دو دوز واکسن خود ، به جای فقط یک مورد هستند. نتایج در سه ماهه سوم سال 2021 پیش بینی می شود. در ماه فوریه ، این شرکت یک آزمایش برای زنان باردار نیز آغاز کرد و در ماه مارس اعلام کرد به زودی آزمایشات مربوط به کودکان را آغاز می کند. مدیر اجرایی جانسون و جانسون در مصاحبه ای در تاریخ 4 مارس گفت که این واکسن می تواند تا سپتامبر برای کودکان در دسترس باشد.
با ظهور نوع دلتا در تابستان 2021 ، جانسون و جانسون نتایج آزمایشاتی را منتشر کردند که نشان می داد واکسن آنها از دوام قابل توجهی در برابر آن محافظت می کند.
استفاده متوقف شده در: دانمارک ، فنلاند جدید.
استفاده اضطراری در: بحرین ، بنگلادش ، بوتسوانا ، برزیل ، کانادا ، شیلی ، کلمبیا ، اتحادیه اروپا ، غنا ، گرینلند ، ایسلند ، کویت ، لیبی جدید ، لیختن اشتاین ، مالزی ، مالدیو ، مکزیک ، مولداوی ، نیجریه ، نروژ ، فیلیپین ، آفریقای جنوبی ، کره جنوبی ، سنت وینسنت و گرنادین های جدید ، سوئیس ، تایلند ، تونس ، انگلستان ، ایالات متحده ، زامبیا. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی. تایید شده توسط گروه تنظیم مقررات آفریقا.
نام واکسن: EpiVacCorona
کارایی: ناشناخته
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
محل نگهداری: تا دو سال در یخچال ثابت است
در تاریخ 26 آگوست ، موسسه وکتور ، یک مرکز تحقیقات بیولوژیکی روسیه ، آزمایش فاز 1/2 را برای یک واکسن ویروس کرونا که آنها EpiVacCorona می نامند ، ثبت کرد. این واکسن حاوی بخشهای کوچکی از پروتئینهای ویروسی است که به عنوان پپتید شناخته می شوند. کمتر از دو ماه بعد ، در 14 اکتبر ، ولادیمیر پوتین اعلام کرد که روسیه از نظر قانونی واکسن را تصویب کرده است ، و این دومین واکسن پس از واکسن Sputnik V موسسه Gamaleya است.
یک آزمایش فاز 3 در ماه نوامبر آغاز شد و از 15 دسامبر ، خبرگزاری اینترفاکس گزارش داد که 1438 داوطلب این واکسن را دریافت کرده اند.
در ژانویه ، روسیه یک کمپین واکسیناسیون گسترده را که شامل EpiVacCorona بود آغاز کرد. در ماه فوریه ، تاس گزارش داد که پاسخ ایمنی از EpiVacCorona "تقریباً یک سال" طول کشید. در تاریخ 3 مارس ، موسسه وکتور آزمایشات خود را در یک رجیستری بین المللی ثبت کرد ، نشان می دهد که انتظار می رود نتایج اولیه را در آگوست 2021 ارائه دهند. Tass در اوایل ماه مه گزارش داد که بیش از 90٪ از افرادی که واکسن دریافت کرده اند ، آنتی بادی تولید کرده اند.
نتایج حاصل از آزمایش EpiVacCorona's Phase 1/2 در اواخر ماه مارس در یک ژورنال مبهم روسیه منتشر شد ، اما این اطلاعات مربوط به متخصصان خارجی است که به نقایص جدی در این مطالعه اشاره کرده اند.
در تاریخ 5 ژوئیه ، Tass گزارش داد که موسسه Vector در حال ثبت واکسن با نام Aurora-CoV است.
در فوریه 2021، تاس گزارش داد که پاسخ ایمنی از EpiVacCorona «تقریباً یک سال» طول کشید، اما سازندگان واکسن جزئیات علمی پشت این ادعا را منتشر نکردند. در 3 مارس 2021، مؤسسه Vector فاز 3 آزمایشی خود را در یک ثبت بینالمللی ثبت کرد، که نشان میدهد آنها انتظار داشتند تا سپتامبر 2021 نتایج اولیه را ارائه دهند. اما آنها هنوز این دادهها را در یک مجله علمی به اشتراک نگذاشتهاند.
سازندگان EpiVacCorona در 1 فوریه 2022 گفتند که با تولید بیش از 50 میلیون دوز از این واکسن برای شرکت های خارجی موافقت کرده اند.
مصوب برای استفاده در: ترکمنستان.
استفاده زودهنگام در: روسیه.
نام واکسن: ZF2001
کارایی: ناشناخته
دوز: 3 دوز ، با فاصله 4 هفته
نوع: تزریق عضله
شرکت چینی Anhui Zhifei Longcom و انستیتوی زیست پزشکی در آکادمی علوم پزشکی چین برای ساخت واکسن همکاری کردند. نامزد آنها از یک کمکی همراه با بخشی از پروتئین سنبله به نام حوزه اتصال گیرنده تشکیل شده است. آنها آزمایشات فاز 2 را در ماه ژوئیه آغاز کردند و پس از آن آزمایش فاز 3 با 29000 داوطلب در ماه دسامبر انجام شد. چین واکسن را برای استفاده اضطراری در 15 مارس مجاز دانست.
در 14 ژوئیه، محققان فاز 1 آزمایشی را برای این واکسن در کودکان و نوجوانان ثبت کردند. آنها در 6 نوامبر به فاز 2 منتقل شدند. این شرکت در 27 اوت اعلام کرد که واکسن آنها دارای میزان اثربخشی 82 درصد در برابر کووید-19 با هر شدتی است. اندونزی Zifivax را در 7 اکتبر مجاز کرد. محققان فاز 3 آزمایشی را در 4 نوامبر ثبت کردند تا آزمایش کنند که چگونه ترکیب Zifivax با واکسن آنفلوانزا باعث تحریک سیستم ایمنی می شود. و در 22 نوامبر، محققان مرحله 3 آزمایش دیگری را برای سنجش اثربخشی ارائه سومین دوز واکسن خود شش ماه پس از اولین دوز ثبت کردند. آنها یک کارآزمایی متفاوت را در 20 ژانویه 2022 برای ارزیابی تقویت کننده 12 ماه پس از تکمیل رژیم اولیه ثبت کردند. در اواخر همان ماه، آنها همچنین آزمایشهایی را برای واکسن به عنوان یک تقویتکننده با CoronaVac و BBIBP-CorV ثبت کردند.
استفاده اضطراری در: چین ، ازبکستان.
Updated Jan. 20Shenzhen Kangtai Biological Products یک شرکت چینی است که برای بیماری هایی مانند هپاتیت B و سرخک واکسن می سازد. در ماه اوت ، AstraZeneca با وجود شنیده ها مبنی بر فساد و رسوایی هایی که باعث آزار این شرکت شده است ، با Shenzhen به توافق رسید تا واکسن آدنوویروس خود را به چین عرضه کند. در اکتبر شنژن کانگتای آزمایش فاز 1 را بر روی 180 داوطلب واکسن خود ، بر اساس ویروس های غیرفعال ، آغاز کرد. در فوریه 2021 این شرکت یک آزمایش فاز 2 را دنبال کرد و یک آزمایش فاز 3 را نیز در ماه مه آغاز کرد. در همان ماه ، این شرکت اعلام کرد که دولت چین به آن اجازه استفاده اضطراری را داده است. اولین داوطلبان در 21 ژوئن در مالزی آمپول زدند.
در ماه مه، این شرکت همچنین اعلام کرد که دولت چین حتی قبل از شروع فاز 3 آزمایشی، مجوز استفاده اضطراری را به آن داده است. در نوامبر 2021، اندونزی واکسن Kangtai را مجاز کرد و این شرکت گفت که 4 میلیون دوز را به آنجا ارسال کرده است - علیرغم عدم وجود نتایج آزمایشی عمومی فاز 3.
استفاده اضطراری در: چین.
Updated Dec. 8شفا فارمد پارس ، یک شرکت دارویی ایرانی ، واکسنی ساخته شده از ویروس های کرونا ویروس غیرفعال ساخته است. نتایج حاصل از آزمایشات بالینی نشان داد که واکسن در حیوانات ایمن و م effectiveثر است. این واکسن که به عنوان COVIran Baretat شناخته می شود ، در اواخر ماه دسامبر وارد آزمایش فاز 1 شد و به اولین واکسن تولید شده در ایران برای آزمایش بالینی تبدیل شد. COVIran Baretat آزمایش فاز 3 را در 25 آوریل آغاز کرد و در 14 ژوئن ، دولت ایران اعلام کرد که واکسن را مجاز کرده است ، با وجود این واقعیت که بسیاری از داوطلبان در آزمایش فاز 3 هنوز دوز دوم خود را دریافت نکرده اند. در 25 ژوئن ، آیت الله خامنه ای واکسن COVIran Baretat را از تلویزیون دریافت کرد.
استفاده اضطراری در: ایران.
Updated June 30تولیدکننده واکسن مستقر در تایوان ، Medigen در حال ساخت واکسنی است که از ترکیبی از پروتئین های سنبله و یک افزودنی از Dynavax ساخته شده است. پس از یک سری آزمایش های امیدوار کننده بر روی حیوانات ، آنها تزریق داوطلبان را برای آزمایش فاز 1 در اوایل اکتبر آغاز کردند ، که نشان داد واکسن واکنش های ایمنی قوی را برانگیخته است. در 30 دسامبر ، Medigen اعلام کرد که مجوز آغاز مرحله آزمایشی مرحله 2 را دریافت کرده است. اولین داوطلبان در آزمایش در اواخر ژانویه 2021 تزریق شدند. در ژوئیه ، Medigen آزمایش دوم مرحله دوم را روی کودکان بین 12 تا 18 سال آغاز کرد. مدیگن در 20 ژوئیه اجازه آغاز محاکمه مرحله 3 در پاراگوئه را دریافت کرد.
تایوان در 19 ژوئیه مجوز استفاده اضطراری را به این واکسن اعطا کرد. نتایج حاصل از آزمایش فاز 2 نشان داد که داوطلبان سطوح قوی آنتی بادی تولید میکنند و واکنشهای جانبی جدی نداشتند. تایوان تجویز واکسن Medigen را در 23 اوت آغاز کرد. تا 22 اکتبر، Medigen گفت که 1,362,524 دوز تزریق شده است.
در 31 ژانویه 2022، Medigen مرحله 2 آزمایشی یک تقویت کننده بر اساس نوع بتا را ثبت کرد. مطالعات حیوانی نشان می دهد که ممکن است محافظت گسترده ای در برابر بسیاری از انواع ویروس کرونا ایجاد کند.
استفاده فوری در: تایوان جدید.
Updated Jan. 31در تاریخ 18 آگوست ، رئیس اپیدمیولوژی وزارت بهداشت عمومی کوبا از اولین آزمایش آزمایش واکسن Covid-19 در این کشور خبر داد. موسسه واکسن Finlay در هاوانا آزمایش واکسنی به نام Soberana 1. را آغاز کرد. این ماده حاوی بخشی از پروتئین سنبله به نام RBD به همراه دو ماده اضافی است: پروتئین های باکتری و هیدروکسید آلومینیوم. این مواد ، که به عنوان کمکی شناخته می شوند ، پاسخ سیستم ایمنی بدن به ویروس کرونا را افزایش می دهند.
در 26 جولای، رسانه های کوبا گزارش دادند که Soberana 1 وارد فاز 2 آزمایشی شده است.
در ماه نوامبر، مقامات بهداشتی کوبا آزمایش بالینی را برای استفاده از Soberana 1 به عنوان دوز تقویت کننده تایید کردند. نتایج حاصل از آزمایش فاز 1 نشان می دهد که Soberana 1 می تواند به طور ایمن ایمنی ایجاد کند، و در صورت ترکیب با Abdala، می تواند با نوع Omicron مبارزه کند.
نام واکسن: عبدالا
کارآیی: 92.28
در نوامبر 2020 ، مرکز مهندسی ژنتیک و بیوتکنولوژی کوبا آزمایش واکسن کرونا به نام عبدالا را آغاز کرد. این نام از شعری از شاعر قرن نوزدهم خوزه مارتی گرفته شده است. واکسن عبدالا شامل یک قطعه از پروتئین سنبله کروناویروس به نام دامنه اتصال گیرنده است و در سه دوز تحویل داده می شود. در 1 فوریه ، این مرکز یک کنفرانس مطبوعاتی را برای اعلام شروع آزمایش مرحله 2 برگزار کرد. مرحله آزمایشی مرحله 3 با حضور 48000 شرکت کننده در 18 مارس آغاز شد. در 12 مه ، در حالی که محاکمه مرحله 3 هنوز در حال انجام بود ، دولت کوبا شروع به استفاده از عبدالا در کمپین واکسیناسیون دسته جمعی کرد ، به امید مهار موج شدید موارد ونزوئلا استفاده از واکسن را در اواخر ژوئن آغاز کرد. در 21 ژوئن ، مقامات کوبا گزارش دادند که اثر ابدالا 92.28 درصد است. مقامات کوبا در 1 ژوئیه محاکمه ابدالا در جوانان را تأیید کردند. در 9 ژوئیه ، دولت کوبا مجوز استفاده اضطراری از واکسن را صادر کرد. عبدالا یکی از دو واکسن کوبائی است که در مرحله 1/2 کارآزمایی بالینی مورد آزمایش قرار گرفته است تا توانایی آنها در افزایش ایمنی در افرادی که قبلاً به کووید -19 مبتلا بوده اند مورد ارزیابی قرار گیرد.
استفاده اضطراری در: کوبا ، ونزوئلا جدید.
Updated Aug. 4قزاقستان در آسیای مرکزی تحقیقات خود را در مورد واکسنی که از کروناویروس های غیر فعال تهیه شده است ، در تابستان آغاز کرد. در 28 آگوست 2020 ، م Instituteسسه تحقیقاتی آنها در زمینه مشکلات ایمنی زیستی آزمایش فاز 1 این واکسن را ثبت کرد. در 19 دسامبر ، Kazinform گزارش داد که محققان مرحله دوم آزمایش را تکمیل کرده و دریافتند که واکسن بی خطر است و پاسخ ایمنی امیدوار کننده ای ایجاد می کند. محققان آزمایش فاز 3 را در ماه مارس آغاز کردند ، معاون وزیر آموزش و علوم قزاقستان اعلام کرد که با وجود عدم انتشار نتایج آزمایش فاز 3 ، انتظار می رود واکسن معروف به QazVac در آوریل مجاز شود.
قزاقستان از واکسن خود برای مردم در اواخر آوریل شروع کرد. در 29 ژوئیه ، مقامات دولتی اعلام کردند که 25000 دوز واکسن را به کشور همسایه قرقیزستان تحویل می دهند.
محققان این موسسه گزارشی از آزمایش فاز 3 خود را در ژانویه 2022 منتشر کردند. آنها دریافتند که این واکسن اثربخشی 82 درصدی در برابر عفونت دارد. کارآزمایی برای تعیین اثربخشی در برابر بیماری شدید بسیار کوچک بود. این مطالعه هنوز در یک مجله علمی منتشر نشده است.
استفاده زود هنگام: قزاقستان.
Updated Feb. 7تایید شده
نام واکسن: Comirnaty (همچنین به عنوان tozinameran یا BNT162b2 نیز شناخته می شود)
کارایی: 95٪
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
ذخیره سازی: ذخیره سازی فریزر فقط در –94 درجه فارنهایت (–70 درجه سانتیگراد)
سازمان بهداشت جهانی این واکسن را تایید کرده است.
در تاریخ 9 نوامبر ، Pfizer مستقر در نیویورک و شرکت آلمانی BioNTech با اعلام اینکه میزان اثر بخشی واکسن ویروس کرونا بیش از 90 درصد است ، بسیار فراتر از انتظار است ، تاریخ سازی کردند. این اولین باری بود که کسی چنین شواهدی را پیدا می کرد. بیش از یک ماه بعد ، در 11 دسامبر ، سازمان غذا و دارو اولین مجوز استفاده اضطراری را که ایالات متحده به واکسن ویروس کرونا داده است ، اعطا کرد. در 10 مه F.D.A. مجوز را برای کودکان 12 ساله گسترش داد.
کار بر روی واکسن در ژانویه سال 2020 آغاز شد ، زمانی که محققان BioNTech شروع به ساختن یک مولکول ژنتیکی به نام RNA پیام رسان (mRNA) کردند. آنها دستورالعمل های ژنتیکی ساخت پروتئین ویروس کرونا را ایجاد کردند ، معروف به سنبله. هنگامی که به سلول ها تزریق می شود ، واکسن باعث ایجاد پروتئین های سنبله ای می شود و سپس در بدن آزاد می شود و پاسخ سیستم ایمنی بدن را تحریک می کند. در ماه مارس ، BioNTech با همکاری Pfizer برای گسترش تحقیقات ، یک آزمایش بالینی را در ماه مه آغاز کرد. آنها به واکسن نام عمومی tozinameran و نام تجاری Comirnaty دادند
در آزمایشات فاز 1 ، محققان دریافتند که Comirnaty باعث تولید داوطلبان آنتی بادی علیه SARS-CoV-2 و همچنین سلولهای ایمنی به نام سلولهای T می شود که به ویروس پاسخ می دهند. در تاریخ 27 ژوئیه ، شرکت ها از آغاز آزمایش فاز 2/3 با حضور 30،000 داوطلب خبر دادند. در 12 سپتامبر ، Pfizer و BioNTech اعلام کردند که به دنبال گسترش دادگاه برای 44000 شرکت کننده هستند.
در طول تابستان و پاییز ، جهان توجه خود را بیشتر به محاکمه Pfizer-BioNTech معطوف کرد. در ماه سپتامبر ، دکتر آلبرت بورلا ، مدیر اجرایی Pfizer ، گفت که به محض ماه اکتبر ، آزمایش فاز 3 نتایج کافی را به دست می دهد تا نشان دهد که آیا واکسن م workedثر است یا خیر. پرزیدنت ترامپ با اشاره به وجود واکسن قبل از انتخابات ، پیشرفت آنها را تبلیغ کرد. اما در تاریخ 27 اکتبر ، دکتر بورلا اعلام کرد که داوطلبان حاضر در این آزمایش هنوز موارد کافی Covid-19 را برای تعیین کارایی واکسن ها تجربه نکرده اند. سرانجام ، در تاریخ 9 نوامبر ، Pfizer و BioNTech تجزیه و تحلیل اولیه خود را در مورد 94 مورد اول منتشر کردند.
طی یک ماه آینده ، Pfizer و BioNTech اطلاعات بیشتری در مورد موارد بیشتر منتشر کردند. در 8 دسامبر ، FDA تجزیه و تحلیل مستقل خود را از آزمایشات بالینی منتشر کرد. آنها تشخیص دادند که میزان Comirnaty 95 درصد است. در حالی که Comirnaty هیچ عارضه جانبی جدی ایجاد نکرد ، اما اغلب باعث خستگی کوتاه مدت ، تب و درد عضلانی می شود.
در تاریخ 2 دسامبر ، انگلستان مجوز اضطراری واکسن Pfizer و BioNTech را صادر کرد و در پی آن کشور های بیشتری به آن واگذار شدند. در تاریخ 31 دسامبر ، سازمان بهداشت جهانی واکسن را لیست استفاده اضطراری قرار داد ، که به سرعت مجوز آن در سراسر جهان سرعت می بخشد. در اسرائیل ، که پیشتاز واکسیناسیون دسته جمعی بود ، محققان دریافتند که این واکسن در دنیای واقعی همانطور که آزمایشات نشان داده است ، م wasثر است. مطالعه منتشر شده توسط مراکز کنترل بیماری در ماه مارس نشان داد که این واکسن بعد از دوز دوم 3/91٪ موثر است. در 7 مه ، Pfizer و BioNTech اعلام کردند که به دنبال F.D.A کامل هستند. تأیید واکسن آنها انتظار می رود روند این کار چند ماه طول بکشد.
با پیشرفت آزمایش ها ، Pfizer و BioNTech همچنین کارخانه های تولید Comirnaty را در مقادیر زیاد افزایش دادند. دولت ترامپ برای اطمینان از عرضه پیش از آن ، در ژوئیه 2020 به 100 میلیون دوز قرارداد 1.9 میلیارد دلاری به Pfizer و BioNTech اعطا کرد ، اما روزنامه نیویورک تایمز در ماه دسامبر گزارش داد که دولت این فرصت را در تابستان برای تأمین 100 میلیون دوز دیگر به دست آورد. . از آن زمان به بعد ، دولت های ترامپ و بایدن توافقاتی را برای مجموع 300 میلیون دوز تا تابستان به دست آوردند. در آوریل 2021 ، اتحادیه اروپا برای معامله 1.8 میلیارد دوز مذاکره کرد ، که باید کمبود بزرگی را که در اوایل انتشار واکسن تجربه کردند ، کاهش دهد. در کل ، BioNTech و Pfizer انتظار دارند در سال 2021 نزدیک به 3 میلیارد دوز تولید کنند.
در حالی که Comirnaty بسیار م provenثر بوده است ، در ابتدا توزیع این واکسن چالش برانگیز بود زیرا باید در دمای 94- درجه فارنهایت (70- درجه سانتیگراد) منجمد نگه داشته می شد. در 19 فوریه ، Pfizer و BioNTech اعلام کردند که می توانند واکسن را در دمای 25- تا 15- درجه سانتیگراد (-13 درجه فارنهایت تا 5 درجه فارنهایت) پایدار نگه دارند.
در ژانویه ، دانشمندان در مورد ظهور انواع سریع گسترش یافته که ممکن است قادر به فرار از آنتی بادی ها باشند ، نگران شدند. مطالعه ای که در ماه مه منتشر شد ، نشان داد كه Comirnaty در برابر برخی از انواع تا حدودی م effectiveثر است ، اما با این وجود محافظت شدیدی دارد. تحقیقات بعدی همچنین نشان داد که Pfizer از محافظت خوبی در برابر Delta ، گونه ای که برای اولین بار در هند شناسایی شد ، برخوردار است.
Comirnaty در حال حاضر در تعدادی آزمایش دیگر مورد آزمایش قرار گرفته است. در فوریه 2021 ، شرکت ها مطالعه ای را برای توسعه یک تقویت کننده خاص بتا اعلام کردند. آنها همچنین یک آزمایش به طور خاص برای زنان باردار و همچنین کودکان بین 5 تا 11 سال دارند. در 30 ژوئن ، پس از نتایج مثبت از محاکمه جوانان ، فایزر گفت که تصویب تصویب اضطراری برای استفاده در کودکان از همان اوایل سپتامبر. در ماه ژوئن ، محققان در آکسفورد نتایج اولیه را اعلام کردند که ترکیبی از واکسن AstraZeneca و به دنبال آن Comirnaty ، مقادیر زیادی آنتی بادی تولید می کند.
دکتر بورلا ، رئیس اجرایی ، گفت که افراد "احتمالاً" طی یک سال از دریافت دو دوز به یک واکسن اضافی نیاز دارند. Pfizer در ژوئن یک آزمایش برای ترکیب یک تقویت کننده با واکسن Prevnar ، برای بیماری پنوموکوک ، آغاز کرد.
مصوب برای استفاده در: بحرین ، برزیل ، نیوزیلند ، عربستان سعودی ، سوئیس.
استفاده اضطراری در: آرژانتین ، استرالیا ، بنگلادش ، برمودا ، بوتسوانا ، برونئی ، کابو ورد NEW ، کانادا ، شیلی ، کلمبیا ، کاستاریکا ، اکوادور ، اتحادیه اروپا ، گرینلند ، گواتمالا ، هنگ کنگ ، ایسلند ، عراق ، اسرائیل ، ژاپن ، اردن ، کویت ، لبنان ، لیبی NEW ، لیختن اشتاین ، مالزی ، مالدیو ، مکزیک ، مولداوی ، موناکو ، مغولستان ، نروژ ، مقدونیه شمالی ، عمان ، پاکستان ، پاناما ، پرو ، فیلیپین ، قطر ، سنت وینسنت و گرنادین های جدید ، صربستان ، سنگاپور ، سریلانکا ، آفریقای جنوبی ، کره جنوبی ، سنت مارتن ، تونس ، ترکیه ، اوکراین ، امارات متحده عربی ، انگلستان ، ایالات متحده ، اروگوئه ، ویتنام NEW. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی. برای استفاده اضطراری توسط سیستم تنظیم مقررات کارائیب توصیه می شود.
تایید شده در چین
نام واکسن: BBIBP-CorV
کارایی: 79.34٪
دوز: 2 دوز ، با فاصله 3 هفته
نوع: تزریق عضله
سازمان بهداشت جهانی این واکسن را تایید کرده است.
موسسه محصولات بیولوژیکی پکن یک واکسن ویروس کرونا ویروس غیرفعال ایجاد کرد که توسط شرکت دولتی چینی Sinopharm در آزمایشات بالینی قرار گرفت. در تاریخ 30 دسامبر ، سینوفرم اعلام کرد که این واکسن دارای اثر 79.34 درصدی است و این باعث می شود دولت چین آن را تأیید کند. در 7 ماه مه ، سازمان بهداشت جهانی تخمین کارآیی مشابه 78.1 درصد را ارائه داد و مجوز استفاده اضطراری از واکسن را صادر کرد. جزئیات دادگاه فاز 3 هنوز در یک مجله علمی منتشر نشده است.
در ماه ژوئن گذشته ، محققان موسسه پکن گزارش دادند که این واکسن نتایج امیدوار کننده ای در میمون ها به وجود آورد. یک آزمایش فاز 1/2 سپس نشان داد که واکسن هیچ عارضه جانبی جدی ایجاد نکرده و افراد را قادر به ساخت آنتی بادی علیه ویروس کرونا می کند. در ماه جولای ، دادگاه فاز 3 در امارات متحده عربی در ماه ژوئیه و در مراکش و پرو در ماه بعد آغاز شد.
در 14 سپتامبر ، U.A.E. تصویب اضطراری واکسن Sinopharm برای استفاده در مراقبت های بهداشتی را انجام داد و به زودی مقامات دولتی و دیگران نیز آن را دریافت کردند. کمتر از دو ماه بعد ، در 9 دسامبر ، U.A.E. تایید کامل BBIBP-CorV ، اعلام کرد که میزان کارایی آن 86 درصد است. از آن زمان تاکنون تعدادی از کشورهای خاور نزدیک آن را مجاز دانسته اند. در تاریخ 29 ژانویه ، مجارستان BBIBp-CorV را مجاز دانست و این کشور را به عنوان اولین کشور اروپایی استفاده کرد که از واکسن چینی استفاده می کند.
در همین حال ، در چین ، دولت تصویب اضطراری Sinopharm را در تابستان 0 تا 2020 صادر کرد. مقامات دولتی ، کارکنان بهداشت و سایر گروه های منتخب شروع به دریافت BBIIP-CorV کردند. در ماه مه ، چین ادعا کرد که می تواند تا پایان سال 2021 تا 5 میلیارد دوز تولید کند ، اما مقامات چینی هشدار دادند که این کشور در تلاش است تا دوزهای کافی برای جمعیت خود تولید کند.
در فوریه 2021 ، همزمان با افزایش نگرانی در مورد جهش های جدید در ویروس کرونا ، محققان چینی BBIBP-CorV را در برابر نوعی به نام B.1.351 آزمایش کردند که اولین بار در آفریقای جنوبی یافت شد. آنها گزارش دادند که پاسخ آنتی بادی ایجاد شده توسط واکسن در برابر B.1.351 فقط نسبتاً ضعیف است. این مطالعه هنوز در یک مجله پزشکی منتشر نشده است. U.A.E. خلیج امروز در 10 ژوئن گزارش داد که اکنون واکسن را در کودکان آزمایش می کند.
در تاریخ 18 مه ، در میان نگرانی در مورد اثربخشی واکسن ، U.A.E. اعلام کرد که عکسهای تقویت کننده ای را برای کسانی که دو دوز BBIBP-CorV دریافت کرده اند فراهم می کند. بحرین با اعلامیه مشابهی در تاریخ 3 ژوئن دنبال کرد.
در ژانویه 2022، تیمی از دانشمندان از چین و امارات متحده عربی، گزارشی منتشر کردن که نشان میداد این تقویتکننده دوز قویتری از آنتیبادیها علیه نوع Omicron نسبت به دوز سوم واکسن ویروس غیرفعال سینوفارم تولید میکند.
مصوب برای استفاده در: بحرین ، چین ، امارات متحده عربی.
استفاده اضطراری در: آنگولا ، آرژانتین ، بنگلادش ، برونئی ، کامبوج ، مصر ، گابن ، گامبیا جدید ، گویان ، مجارستان ، اندونزی ، ایران ، عراق ، اردن ، لبنان ، مالدیو ، مولداوی ، مغولستان ، مراکش ، نامیبیا ، نپال ، مقدونیه شمالی ، پاکستان ، پرو ، فیلیپین ، سیرالئون ، جزایر سلیمان NEW ، سریلانکا ، تایلند ، ویتنام ، ونزوئلا ، زیمبابوه. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی.
نام واکسن: mRNA-1273
کارایی: 94.5٪
دوز: 2 دوز ، با فاصله 4 هفته
نوع: تزریق عضله
ذخیره سازی: 30 روز با یخچال ، 6 ماه در –4 درجه فارنهایت (–20 درجه سانتیگراد)
سازمان بهداشت جهانی این واکسن را تایید کرده است.
در 18 دسامبر ، F.D.A. مجوز استفاده اضطراری برای واکسن ساخته شده توسط شرکت مدرنا مستقر در بوستون را داد. واکسن Moderna دومین واکسن مجاز توسط F.D.A است که یک هفته پس از واکسن ساخته شده توسط Pfizer و BioNTech وارد می شود. در تاریخ 1 ژوئن 2021 ، مدرنا اعلام کرد که به دنبال مجوز کامل برای واکسن خود است.
مانند Pfizer و BioNTech ، Moderna واکسن خود را از mRNA تهیه می کند. در سال های اخیر ، این شرکت واکسن mRNA را برای تعدادی بیماری آزمایش کرده است ، اما هنوز واکسن های آن را به بازار عرضه نکرده اند. در ژانویه گذشته ، آنها شروع به تولید واکسن برای ویروس کرونا کردند.
دولت ایالات متحده تلاشهای Moderna را با پشتیبانی تقریباً 1 میلیارد دلاری با حساب مالی ارائه كرد. آنها با همکاری موسسه ملی بهداشت دریافتند که این واکسن از میمون ها در برابر ویروس کرونا محافظت می کند. مارس گذشته ، دانشمندان اولین کسی بودند که واکسن Covid-19 را در آزمایشات انسانی قرار دادند. پس از آنکه نتایج این مطالعات امیدوار کننده بود ، آزمایش مرحله 3 روی 30،000 داوطلب از 27 جولای آغاز شد.
در 16 نوامبر ، Moderna اولین داده های مقدماتی آزمایش را اعلام کرد و به دنبال آن اطلاعات کامل در 30 نوامبر منتشر شد. محققان تخمین زدند که میزان واکسن 94.1 درصد است. گرچه مشخص نیست این اثر چقدر دوام خواهد داشت ، Moderna دریافت که بعد از سه ماه شرکت کنندگان در آزمایش همچنان از یک دفاع ایمنی قوی در برابر ویروس کرونا استفاده می کنند. در تاریخ 25 مه 2021 ، مدرنا اعلام کرد که این واکسن با اطمینان از کودکان 12 ساله محافظت قوی می کند. این شرکت در حال آزمایش واکسن در نوزادان و کودکان خردسال است.
در همین حال ، این شرکت برای تأمین واکسن تا زمان تأیید با چندین کشور وارد معاملات شد. در 11 آگوست سال گذشته ، در صورت اثبات ایمنی و موثر بودن واکسن ، دولت ایالات متحده 1.5 میلیارد دلار در ازای 100 میلیون دوز اضافی به این شرکت اعطا کرد. مذاکرات اضافی توافق را به 500 میلیون دوز افزایش داده است. کمیسیون اروپا 460 میلیون دوز را تأمین کرده است. Moderna معاملات مشابهی را با کشورهای دیگر از جمله کانادا ، ژاپن ، قطر و کره جنوبی انجام داده است. Moderna همچنین متعهد شده است 500 میلیون دوز به COVAX ، یک ابتکار جهانی واکسن ، برای تأمین واکسن به کشورهای کم درآمد بدهد. در 29 آوریل ، مدرنا اعلام کرد که 800 میلیون تا 1 میلیارد دوز در سال 2021 تولید می کند و قصد دارد 3 میلیارد دوز در سال 2022 تولید کند.
آزمایش های انجام شده بر روی واکسن Moderna نشان می دهد که این ماده محافظت شدیدی در برابر انواع غالب مانند بتا و دلتا ایجاد می کند. در ماه مارس ، Moderna آزمایش فاز 1 واکسن mRNA جدیدی را که به طور خاص برای نوع بتا ساخته شده بود ، آغاز کرد. یک نوع تقویت کننده خاص واکسن Moderna نتایج مثبتی را در انسان و موش به همراه داشته است. همچنین در حال انجام آزمایش فاز 1 واکسن جدید و پایدار در یخچال است. واکسن Moderna’s یکی از چندین واکسنی است که در مطالعه آکسفورد مورد آزمایش قرار گرفته و اندازه گیری می کند که دوزهای متناوب چگونه می توانند ایمنی بدن را تقویت کنند. N.I.H. یک آزمایش بالینی را برای ارزیابی واکسن Moderna's به عنوان یک تقویت کننده آغاز کرده است.
مصوب برای استفاده در: سوئیس.
استفاده اضطراری در: بوتسوانا ، کانادا ، اتحادیه اروپا ، گرینلند ، گواتمالا ، هندوراس ، ایسلند ، اسرائیل ، ژاپن ، کویت ، لیبی جدید ، مالدیو ، مولداوی ، مغولستان ، نروژ ، فیلیپین ، قطر ، سنت وینسنت و گرنادین های جدید ، سنگاپور ، جنوب کره ، تایوان ، تایلند ، انگلستان ، ایالات متحده ، ویتنام. اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی.
نام واکسن: AZD1222 (در هند با نام Covishield نیز شناخته می شود)
کارایی: بسته به مقدار مصرف ، 62 تا 90 درصد است
دوز: 2 دوز ، با فاصله 4 هفته
نوع: تزریق عضله
محل نگهداری: حداقل 6 ماه در یخچال ثابت است
سازمان بهداشت جهانی این واکسن را تایید کرده است.
واکسنی که توسط دانشگاه آکسفورد طراحی شده و توسط شرکت انگلیسی-سوئدی AstraZeneca تولید شده است به عنوان یک عنصر اصلی در تلاش برای تأمین تقاضای جهانی واکسن Covid-19 ظاهر شده است. با کارآیی 76 درصدی ، واکسن - که اکنون با نام Vaxzevria شناخته می شود - در مقادیر گسترده و با قیمت پایین تولید می شود. از آنجا که فقط به جای یخ زدگی باید در یخچال نگهداری شود ، می توان بسیار گسترده تر از واکسن های mRNA استفاده کرد. اما سفر Vaxzevria ناآرام بوده است ، و پیام های گیج کننده AstraZeneca ، نگرانی های برجسته در مورد ایمنی و مشکلات تولید را به لرزه در آورده است.
در اوایل سال 2020 ، محققان آکسفورد این واکسن را با مهندسی ژنتیک یک آدنو ویروس که به طور معمول شامپانزه ها را آلوده می کند ، تولید کردند. هنگامی که آنها واکسن را به میمون ها دادند ، دریافتند که از حیوانات در برابر بیماری محافظت می کند.
آنها که با AstraZeneca سر و کار داشتند ، آنها با یک آزمایش فاز 1/2 پیگیری کردند. تولید کنندگان واکسن در آزمایش هیچ عارضه جانبی شدیدی را مشاهده نکردند ، در حالی که مشاهده کردند واکسن باعث افزایش آنتی بادی علیه ویروس کرونا و همچنین سایر سیستم های دفاعی ایمنی می شود. AstraZeneca و آکسفورد سپس در انگلستان ، آفریقای جنوبی و جاهای دیگر مراحل آزمایشی را آغاز کردند. اما محققان این آزمایشات را به طور مستقل انجام دادند ، بنابراین ترکیب نتایج آنها در یک تصویر واضح و واضح از چگونگی عملکرد واکسن دشوار است. بدتر از همه ، آنها مقادیر مختلفی از واکسن را به افراد مختلف دادند و همچنین چهار یا دوازده هفته منتظر ماندند تا دوز دوم را تحویل دهند.
در 8 دسامبر ، AstraZeneca و آکسفورد اولین مقاله علمی را در مورد آزمایش بالینی فاز 3 واکسن ویروس کرونا منتشر کردند. این آزمایش نشان داد که این واکسن می تواند از افراد در برابر Covid-19 محافظت کند ، اما بسیاری از س questionsالات در مورد نتایج حل نشده باقی مانده است. با این وجود ، کم هزینه بودن و سهولت ذخیره سازی واکسن ، آن را برای کشورهایی که به دنبال راهی برای خروج از بیماری همه گیر هستند ، جذاب کرده است. انگلستان و آرژانتین اولین کشورهایی بودند که در 30 دسامبر مجوز واکسن را برای موارد اضطراری صادر کردند. در 3 ژانویه ، هند نسخه ای به نام Covishield را که توسط م Instituteسسه سرم هند ساخته شده است ، تصویب کرد. در 16 فوریه سازمان بهداشت جهانی واکسن را برای استفاده اضطراری در بزرگسالان 18 سال یا بالاتر توصیه کرد. برزیل در 13 مارس این واکسن را تأیید کامل کرد. در همان ماه ، کوواکس تحویل میلیون ها دوز واکسن را به کشورهای با درآمد کم و متوسط آغاز کرد. این شرکت انتظار می رود ظرفیت تولید سالانه دو میلیارد دوز باشد.
با این وجود حتی پس از اینکه میلیون ها نفر واکسن را دریافت کردند ، نگرانی های جدیدی ایجاد شد. در آفریقای جنوبی ، یک محاکمه کوچک نتوانست نشان دهد که مردم را در برابر نوع B.1.351 ، که در این کشور غالب شده است ، محافظت می کند. در 7 فوریه ، آفریقای جنوبی برنامه تولید 1 میلیون دوز واکسن AstraZeneca را متوقف کرد.
در مارس 2021 ، نگرانی دیگری پدیدار شد. تنظیم کننده های پزشکی اروپا نگران تعداد اندکی از موارد لخته شدن خون در افراد جوانی که واکسزوریا را دریافت کرده اند شدند. آژانس دارویی اروپا به این نتیجه رسید که این واکسن یک عارضه جانبی بسیار نادر دارد که در آن افراد دچار لخته شدن خون در رگهای بزرگ همراه با پلاکت کم می شوند. نهادهای نظارتی تأکید کردند که واکسن م effectiveثر است و فواید آن بیشتر از خطر ناچیز عوارض آن است. در پاسخ برخی از کشورها تصمیم گرفتند با محدود کردن واکسن به افراد مسن ، خطر را به حداقل برسانند. در ماه مه ، نروژ Vaxzevria را به طور دائم از برنامه واکسیناسیون خود حذف کرد.
با وجود حمایت جنجالی که از توسعه آن ارائه شده ، ایالات متحده هنوز مجوز واکسزوریا را نداده است. در سال 2020 ، دولت یک میلیارد دلار به AstraZeneca برای پرداخت تحقیقات ، آزمایشات بالینی و تولید کمک کرد. در آن تابستان ، این شرکت قول داد که به زودی در ماه اکتبر Vaxzevria را در ایالات متحده توزیع کند. اما نگرانی در مورد سلامت یک داوطلب در کارآزمایی بالینی ایالات متحده ، مطالعه را به مدت هفت هفته متوقف کرد. AstraZeneca نتایج دادگاه را تا مارس 2021 تحویل نداد - فقط توسط مشاوران متخصص خود برای داده های برداشت گیلاس سرزنش شد. دو روز بعد ، این شرکت اعلام کرد که بررسی کامل آزمایشات نشان داد که این واکسن 76 درصد در برابر Covid-19 و 100 درصد در برابر بیماری شدید و بستری شدن در بیمارستان اثر دارد. AstraZeneca در حال آماده سازی برنامه خود برای F.D.A. برای مجوز کامل
AstraZeneca حتی در حالی که در حال انجام آزمایشات بالینی بود ، برای تولید میلیاردها دوز Vaxzevria با تعدادی از تولیدکنندگان به توافق رسید. اما در ژانویه 2021 ، آن اعتراف کرد که از تحویل واکسن های وعده داده شده به اتحادیه اروپا بازمانده است. کمبود آن در مارس زمانی بدتر شد که هند ، با انفجار موارد جدید ، مانع از صادرات واکسن از کارخانه های خود شد. در تاریخ 26 آوریل ، کمیسیون اروپا شکایتی علیه این شرکت به دلیل نقض قرارداد ارائه داد. دادگاه در 18 ژوئن به AstraZeneca دستور داد 50 میلیون دوز اضافی Vaxzevria تحویل دهد ، كه كمتر از 90 میلیون كمیسیون اروپا بود.
در بهار ، در حالی که سایر کشورها با موج های جدید ویرانگر Covid-19 دست و پنجه نرم می کردند ، ایالات متحده تحت انتقاد شدید برای جلوگیری از مواد اولیه هند مورد نیاز هند برای تهیه کوویشیلد خود قرار گرفت. در تاریخ 25 آوریل ، دولت بایدن اعلام کرد که ممنوعیت خود را تا حدی لغو خواهد کرد. اما منتقدان همچنین به انبار میلیون ها دوز واکسن AstraZeneca اشاره دارند که ایالات متحده سال گذشته شروع به ساخت آن کرده است. اکنون که ایالات متحده به اندازه کافی واکسن از شرکت های دیگر گرفته است تا بتواند از همه شهروندان خود محافظت کند ، تماس هایی برای ارسال واکسن AstraZeneca به هند و سایر کشورهایی که نیاز مبرم دارند وجود دارد. در تاریخ 25 آوریل ، دکتر آنتونی فاوسی گفت که دولت ایالات متحده در حال بررسی ارسال واکسن ها است. اما در اواخر ماه ژوئن ، واکسن ها هنوز آزاد نشده بودند.
در همین حال ، AstraZeneca و آکسفورد تحقیقات در مورد واکسن را ادامه می دهند. در 14 فوریه ، آنها اعلام کردند که آزمایشات مربوط به کودکان 6 ساله را آغاز می کنند. در ماه ژوئن ، محققان آکسفورد گزارش دادند که سومین تقویت کننده واکسن AstraZeneca پاسخ های ایمنی شدیدی را در داوطلبان ایجاد می کند. در یک مطالعه جداگانه ، تیم دیگری از
مصوب برای استفاده در: برزیل.
استفاده متوقف شده در: دانمارک ، نروژ.
استفاده اضطراری در: الجزایر ، آنگولا ، آنتیگوا ، آرژانتین ، استرالیا ، باهاما ، بحرین ، بنگلادش ، باربادوس ، برمودا ، بوتان ، بوتسوانا ، برزیل ، برونئی ، کابو ورد جدید ، کامبوج ، کانادا ، شیلی ، کلمبیا ، کاستاریکا ، قبرس ، دومنیکن جمهوری ، اکوادور ، مصر ، السالوادور ، اتیوپی ، اتحادیه اروپا ، فیجی ، جورجیا ، غنا ، گرینلند ، گواتمالا ، هائیتی ، هندوراس ، مجارستان ، ایسلند ، هند ، اندونزی ، ایران ، عراق ، جامائیکا ، ژاپن ، کنیا ، کویت ، لبنان ، لیبی جدید ، لیختن اشتاین ، مالزی ، مالدیو ، مکزیک ، مولداوی ، مغولستان ، مراکش ، نامیبیا ، نپال ، نیجریه ، مقدونیه شمالی ، نروژ ، پاکستان ، پاناما ، پاپوآ گینه نو ، پرو ، فیلیپین ، رواندا ، عربستان سعودی ، صربستان ، سیشل ، سیرا لئون ، جزایر سلیمان ، آفریقای جنوبی ، کره جنوبی ، سریلانکا ، سنت وینسنت و گرنادین های جدید ، سنت کیتس و نویس ، سودان ، تایوان ، تایلند ، تیمور لست ، اوگاندا ، اوکراین ، انگلستان ، وانواتو NEW ، ویتنام ، زامبیا . اعتبار سنجی استفاده اضطراری از سازمان بهداشت جهانی. تایید شده توسط گروه تنظیم مقررات آفریقا. برای استفاده اضطراری توسط سیستم تنظیم مقررات کارائیب توصیه می شود.
رها شده
در 10 دسامبر ، واکسنی از دانشگاه کوئینزلند استرالیا اولین واکسنی بود که پس از ورود به یک آزمایش بالینی رها شد. لغو واکسن به معنای سقوط قرارداد یک میلیارد دلاری با دولت استرالیا برای 51 میلیون دوز بود.
مطالعات واکسن در ابتدا نویدبخش بود. آزمایش بر روی همستر نشان داد که واکسن از آنها در برابر ویروس کرونا محافظت می کند. این دانشگاه آزمایش های فاز 1 را در ژوئیه با ترکیب پروتئین های سنبله ویروس کرونا با مواد کمکی ساخته شده توسط CSL راه اندازی کرد. آنها هنگامی که کشف ناخواسته ای را انجام دادند در مسیر انتقال به آزمایشات مرحله آخر بودند: برخی از داوطلبان آزمایشات مثبتی را برای HIV انجام می دادند ، حتی اگر در واقع به آن ویروس آلوده نشده بودند.
طبق گزارشات اولیه ، به نظر می رسد مشکل در نحوه طراحی واکسن توسط محققان باشد. اگر پروتئین های سنبله در ویروس کرونا متصل نباشند ، می توانند آشکار شوند. آنتی بادی های پروتئین سنبله باز نشده ممکن است در برابر پروتئین های تا شده روی ویروس های واقعی کار نکنند. بنابراین محققان با ایجاد تغییر کوچکی در پروتئین ، در انتهای آن کمی گیره ایجاد کردند تا مولکول در شکل مناسب خود نگه داشته شود. متأسفانه گیره مشابه پروتئین موجود در HIV است که می تواند سیستم ایمنی بدن را به سمت تولید آنتی بادی های مشابه HIV سوق دهد. افرادی که داوطلب آزمایش واکسن شده اند ، حتی اگر کاملاً سالم بودند ، در آزمایش آنتی بادی HIV مثبت عمل کردند. این کشف کافی بود تا دولت استرالیا محاکمه را منتفی کند. نخست وزیر اسکات موریسون در یک کنفرانس مطبوعاتی برای اعلام لغو گفت: "این برنامه دیگر در طرح واکسن استرالیا نخواهد بود."
اما محققان کوئینزلند هنوز در پلت فرم واکسن خود نویدهایی یافته اند. در آوریل 2021، آنها نتایج کامل آزمایش فاز 1 رها شده خود را منتشر کردند، که نشان می داد کاندید هنوز می تواند در برابر کووید-19 موثر باشد. محققان اکنون در تلاشند تا واکسن خود را با پروتئین های مختلف مهندسی مجدد کنند که مثبت کاذب برای HIV تولید نکند. آنها هنوز یک جدول زمانی برای توسعه یک واکسن به روز ارائه نکرده اند.

در 1 آوریل 2021 ، محققان فرانسوی OSE Immunotherapeutics اعلام کردند که تأیید شده اند تا مرحله اول آزمایش واکسن ، به نام CoVepiT ، را در بلژیک آغاز کنند. واکسن آنها می تواند به بدن آموزش دهد تا در برابر 11 پروتئین مختلف ویروس کرونا واکنش ایمنی ایجاد کند. محققان این پروتئین ها را انتخاب کردند زیرا احتمال جهش آنها کم است-آنها می گویند این ویژگی باعث می شود واکسن "مقاوم در برابر انواع" باشد. آنها دوز مصرف کنندگان را در 26 مه آغاز کردند. اما در 19 ژوئیه ، OSE اعلام کرد که پس از دریافت اخبار اولیه از واکنشهای نامطلوب به واکسن ، داوطلبانه آزمایش خود را متوقف می کند.
در ماه اکتبر، این شرکت گفت که آزمایش هنوز متوقف شده است. OSE در 30 نوامبر گفت که نتایج اولیه آزمایش نشان می دهد که واکسن در ایجاد پاسخ ایمنی موثر بوده است.
محققان امپریال کالج لندن یک واکسن RNA "خود تقویت کننده" تولید کرده اند که تولید پروتئین ویروسی را برای تحریک سیستم ایمنی بدن افزایش می دهد. آنها آزمایش 15/1 فاز را از 15 ژوئن با مشارکت Morningside Ventures برای تولید و توزیع واکسن از طریق یک شرکت جدید به نام VacEquity Global Health آغاز کردند. در تاریخ 18 دسامبر ، محققان از همکاری با Enesi Pharma برای تهیه نسخه ای جامد از واکسن که می تواند بدون سوزن در پوست کاشته شود ، خبر دادند.
در تاریخ 27 ژانویه ، رابین شاتاک ، رهبر این پروژه ، اعلام کرد که "زمان مناسبی برای شروع یک آزمایش کارآیی جدید برای یک واکسن بیشتر در انگلیس نیست." آنها به جای رقابت با واکسن های مجاز ، تلاش خود را برای ایجاد کاندیداهایی معطوف می کنند که از انواع ویروس کرونا استفاده کنند.
Updated Jan. 28
شرکت آمریکایی مرک در ماه ژوئن شرکت اتریشی Themis Bioscience را برای تولید واکسن خود که در اصل در انستیتو پاستور تولید شده بود ، خریداری کرد. در این واکسن از ویروس سرخک ضعیف شده استفاده شده است که حامل ژنی برای پروتئین سنبله ویروس کرونا است. محققان یک آزمایش فاز 1 را در ماه آگوست آغاز کردند. در 25 ژانویه ، مرک اعلام کرد که این تلاش را رها می کند ، زیرا واکسن پاسخی ضعیف تر از یک عفونت طبیعی ایجاد کرد.
در ماه مارس آنها با جانسون و جانسون وارد شراکت شدند تا به جای آن به تولید واکسن خود کمک کنند.

مرک علاوه بر پروژه خود با تمیس ، با IAVI در مورد واکسن ناقل ویروس دوم نیز همکاری کرد. این ویروس بر اساس ویروسهای استوماتیت وزیکولار بود ، همان روشی که مرک با موفقیت در تولید اولین واکسن تایید شده برای ابولا به کار برد. آنها واکسن ویروس کرونا را به صورت قرص طراحی کردند ، که توزیع آن را نسبت به سرنگ های تزریقی آسان می کرد. مرک و IAVI 38 میلیون دلار از دولت ایالات متحده برای حمایت از تحقیقات خود دریافت کردند و در 30 سپتامبر آنها یک آزمایش فاز 1 را ثبت کردند. اما در تاریخ 25 ژانویه ، آنها اعلام کردند که تلاش خود را کنار می گذارند زیرا این واکسن نتوانست سیستم ایمنی قابل مقایسه ای با آنچه در عفونت طبیعی Covid-19 اتفاق می افتد را تحریک کند.
Updated Jan. 25